 |
Введение. История изучения ферментов. Классификация
|
|
|
|
Введение
Ферменты — это белковые молекулы, синтезируемые живыми клетками. В каждой клетке имеются сотни различных ферментов. С их помощью осуществляются многочисленные химические реакции, которые могут с большой скоростью идти при температурах, подходящих для данного организма, т. е. в пределах от 5 до 40°С. Чтобы эти реакции с той же скоростью протекали вне организма, потребовались бы высокие температуры и резкие изменения некоторых других условий. Для клетки это бы означало гибель, ибо вся работа клетки строится таким образом, чтобы избежать любых сколько-нибудь заметных изменений в нормальных условиях ее существования. Ферменты, следовательно, можно определить как биологические катализаторы, т. е. как вещества, ускоряющие реакции. Они абсолютно необходимы, потому что без них реакции в клетке протекали бы слишком медленно и не могли поддерживать жизнь.
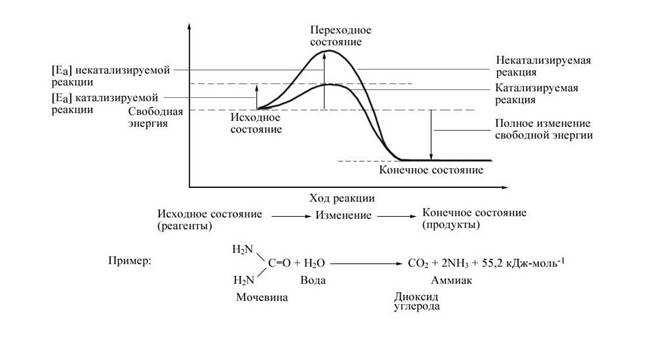
Рис. 1. Энергетические барьеры катализируемой и некатализируемой реакций.
История изучения ферментов
В 1814 году химик К. Г. С. Кирхгоф открыл ферментативное действие водных вытяжек из проросшего ячменя, расщеплявших крахмал до сахара. Можно считать, что эти работы положили начало энзимологии (ферментологии) как самостоятельному разделу биологической химии.
В 1833 году французскими химиками А. Пайеном и Ж. Персо впервые был выделен из солода препарат фермента амилазы, что способствовало развитию препаративной химии Ф.
В середине XIX века разгорелась дискуссия о природе брожения между Л. Пастером, с одной стороны, и Ю. Либихом, П. Э. М. Бертло и К. Бернаром — с другой. Опираясь на свои классические работы, Пастер развивал представление о том, что брожение вызывается лишь живыми микроорганизмами и что процесс брожения неразрывно связан с их жизнедеятельностью. Либих и его сторонники, отстаивая химическую природу брожения, считали, что оно является следствием образования в клетках микроорганизмов растворимых Ф., подобных выделяемой их солода амилазе. Однако все попытки выделить из разрушенных дрожжевых клеток растворимый Ф., способный вызывать брожение, не удавались.
|
|
|
Дискуссия Либиха и Пастера о природе брожения была разрешена в 1897 году Э. Бухнером, который, растирая дрожжи с инфузорной землей, выделил из них бесклеточный растворимый ферментный препарат (названный им амилазой), вызывавший спиртовое брожение. Открытие Бухнера утвердило материалистическое понимание природы брожения и имело большое значение для дальнейшего развития как энзимологии, так и всей биохимии.
В начале XX века Р. Вильштеттер с сотрудниками стал широко применять для выделения и очистки Ф. метод адсорбции. Работы Вильштеттера, имевшие большое значение для характеристики свойств отдельных Ф., привели вместе с тем к принципиально неправильному выводу, что Ф. не принадлежат ни к одному из известных классов органических соединений.
Выдающимся успехом в выяснении химической природы Ф. были исследования американских биохимиков Дж. Самнера, выделившего в 1926 году в кристаллическом виде Ф. уреазу из семян канавалии, и Дж. Нортропа, получившего в 1930 году кристаллы протеолитического Ф. пепсина. Работы Самнера и Нортропа указали путь получения высокоочищенных препаратов Ф. и вместе с тем неопровержимо доказали белковую природу Ф.
В середине XX века благодаря развитию методов физико-химического анализа (главным образом хроматографии) и методов белковой химии расшифрована первичная структура многих Ф. Так, работами американских биохимиков С. Мура, У. Стайна и К. Анфинсена показано, что Ф. рибонуклеаза из поджелудочковой железы быка представляет собой полипептидную цепочку, состоящую из 124 аминокислотных остатков, соединенных в 4-х местах дисульфидными связями.
|
|
|
С помощью рентгеноструктурного анализа расшифрована вторичная и третичная структура ряда Ф. Так, методом рентгеноструктурного анализа английский ученый Д. Филлипс в 1965 году установил трехмерную структуру Ф. лизоцима. Показано, что многие Ф. обладают также четвертичной структурой, т. е. их молекула состоит из нескольких идентичных или различных по составу и структуре белковых субъединиц.
Классификация
В 1961 году специальной комиссией Международного биохимического союза была предложена систематическая номенклатура ферментов. Каждый фермент получил систематическое наименование, точно описывающее катализируемую им реакцию, также ему было присвоено и “тривиальное”, рабочее название. Оно состоит из названия субстрата, на который действует данный фермент, указания на тип катализируемой реакции и окончания “- аза”.
Пример. Рибулозобисфосфаткарбоксилаза; здесь субстрат — рибулозобисфосфат (+CO2), а тип реакции — карбоксилирование (добавление CO2).
Каждый класс Ф. подразделяется на подклассы, которые в свою очередь в зависимости от природы ферментативной реакции делятся еще на подподклассы, в пределах которых нумеруются. Шифр (индекс) каждого Ф. содержит 4 числа, разделенных точками. Первая цифра указывает класс, вторая — подкласс, третья — подподкласс, четвертая порядковый номер в данном подподклассе.
Пример. Ф. аргиназа, расщепляющий аргинин на орнитин и мочевину, имеет шифр 3. 5. 3. 1, т. е. относится к классу гидролаз, подклассу Ф., действующих на непептидные C-N-связи, и подподклассу Ф., расщепляющих эти связи в линейных соединениях.
| Таблица 1. Классификация ферментов | |||
| Класс | Катализируемая реакция | Типичная реакция | Примеры ферментов |
| Оксидоредуктазы | Перенос атомов H и O или электронов от одного вещества к другому. Разделяется на 14 подклассов в зависимости от природы той группы в молекуле субстрата, которая подвергается окислению (спиртовая, альдегидная, кетонная и т. д. ). Подподклассы оксидоредуктаз индексируются в зависимости от типа участвующего в реакции акцептора водорода (электронов) — кофермента, цитохрома, молекулярного кислорода и т. д. | AH+B ↔ A+BH (окисленный) A+O ↔ AO (восстановленный) | Дегидрогеназа, оксидаза |
| Трансферазы | Перенос определенной группы атомов — метильной, ацильной, фосфатной или аминогруппы — от одного вещества к другому. Подразделяется на 8 подклассов в зависимости от природы переносимых групп, которыми могут быть одноуглеродные или гликозильные остатки, азотистые или содержащие серу группы и т. д. У трансфераз третья цифра характеризует тип переносимых групп (например, одноуглеродная группа может быть метилом, карбоксилом, формилом и т. д. ). | AB+C ↔ A+BC | Трансаминаза, киназа |
| Гидролазы | Реакции гидролиза, при которых из субстрата образуются два продукта. Разделяются на 9 подклассов в зависимости от типа гидролизуемой связи — связи — сложноэфирной, пептидной, гликозидной и т. д. Третья цифра у гидролаз уточняет тип гидролизуемой связи. | AB+H2O ↔ AOH+BH | Липаза, амилаза, пептидаза. |
| Лиазы | Негидролитическое присоединение к субстрату или отщепление от него группы атомов. При этом могут разрываться связи C-C, C-N, C-O или C-S. У лиаз 5 подклассов, вторая цифра обозначает тип подвергающейся разрыву связи (C-C, C-O и т. д. ), а третья — тип отщепляемой группы. | O O O || || || R-C--C-OH ↔ R-C-H+CO2 | Декарбоксилаза, фумараза, альдолаза. |
| Изомеразы | Внутримолекулярная перестройка. Разделяются на 5 подклассов в зависимости от типа катализируемой реакции, третья цифра детализирует характер превращения субстрата. | AB ↔ BA | Изомераза, мутаза |
| Лигазы | Соединение двух молекул в результате образования новых связей C-O, C-S, C-N или C-C, сопряженного с распадом АТФ. Первая цифра обозначает тип вновь образуемой связи (C-N, C-O и т. д. ), а вторая — природу образующегося соединения. | X+Y+АТФ ↔ XY+АДФ+Фн | Синтетаза |
|
|
|
|
|
|


