 |
Коферменты (НАД, НАДФ, кофермент А, АТФ)
|
|
|
|
Коферменты (НАД, НАДФ, кофермент А, АТФ)
Пример. Никотинамидадениндинуклеотид (НАД), производная никотиновой кислоты, может существовать как в окислительной, так и в восстановительной форме. В окислительной форме НАД при катализе играет роль акцептора водорода:

Здесь E1 и E2 — две различные дегидрогеназы. Конечный результат: 2H переносятся от A к B. Здесь в качестве связующего звена между двумя различными ферментными системами E1 и E2 действует кофермент.
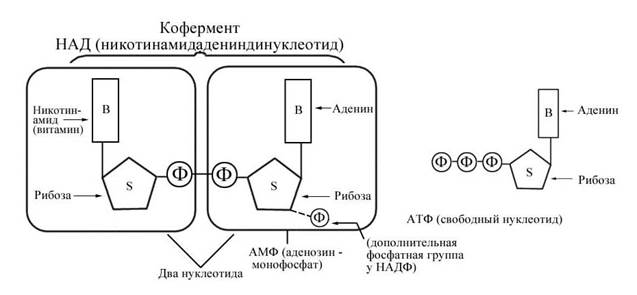
Рис. 9 Витамин как компонент кофермента (представлены структуры НАД, НАДФ и АТФ).
Механизм действия ферментов
Энергия активации. Принцип действия ферментов

Рис. 10
Для того, чтобы заставить субстраты вступить в реакцию, необходима энергия, она называется энергией активации (Δ G‡). Чем больше требуемая энергия активации, тем ниже скорость реакции при данной температуре. Ферменты, действуя как катализаторы, снижают энергию активации, которая требуется для того, чтобы могла произойти реакция. Они повышают общую скорость реакции, не изменяя в сколько-нибудь значительной степени температуру, при которой эта реакция протекает.
Фермент, соединяясь с субстратом, образует короткоживущий фермент-субстратный комплекс (E-S-комплекс). В таком комплексе шанс на то, что реакция произойдет, значительно возрастают. По завершении реакции E-S-комплекс распадается на продукт (или продукты) и фермент. Фермент в реакции не изменяется: по окончании реакции он остается таким же, каким был до нее, и может теперь взаимодействовать с новой молекулой субстрата.
Фермент + Субстрат → E-S-комплекс → Фермент/Продукт(ы)
Способы увеличения скорости реакции ферментами
|
|
|
- Понижение свободной энергии переходного состояния путем стабилизации активированного комплекса.
- Увеличение энергии субстрата, когда тот связывается с ферментом при образовании E-S-комплекса. В итоге уменьшается разность свободных энергий E-S-комплекса и переходного состояния.
- Поддерживание микроокружения активного центра в состоянии, отличном от такого в водной среде. Часто у боковых цепей аминокислотных остатков, находящихся в области активного центра, способность приобретать электрический заряд изменяется по сравнению с тем случаем, когда эти цепи погружены в водную среду. В результате боковые цепи могут обладать “повышенной реактивностью”.
- Расположение реагирующих атомов в правильной ориентации и на необходимом расстоянии друг от друга, так чтобы обеспечить оптимальное протекание реакции. Столкновения атомов в отсутствии фермента очень редко приводят к химической реакции, поскольку в этом случае очень редко атомы оказываются в правильной ориентации.
Активный центр
Молекулы большинства ферментов во много раз больше, чем молекулы тех субстратов, которые активируют данный фермент, причем в контакт с субстратом в E-S-комплексе вступает лишь очень небольшая часть молекулы фермента — обычно от 3 до 12 аминокислотных остатков. Хотя эти остатки пространственно сближены, в линейной последовательности белка они часто далеко отстоят друг от друга.

Рис. 11 Схематическое изображение Е-S-комплекса (субстрат присоединяется к ферменту в активном центре последнего).
Эту часть молекулы фермента называют активным центром. Именно здесь происходит связывание субстрата или субстратов.
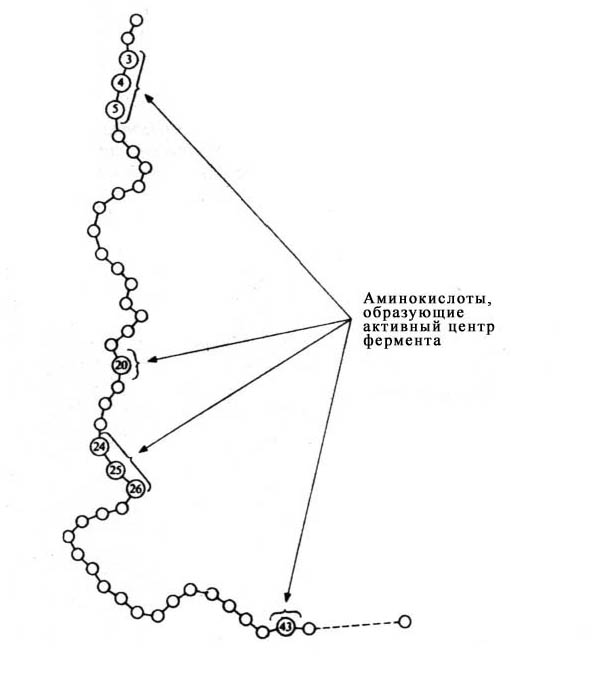
Рис. 12 Положение аминокислотных остатков, образующих активный центр фермента, в первичной структуре ферментного белка).
Роль остальных аминокислотных остатков, составляющих основную массу фермента, состоит в том, чтобы обеспечить его молекуле правильную глобулярную форму, которая очень важна для того, чтобы активный центр фермента мог работать наиболее эффективно.
|
|
|
Как правило, формирование E-S-комплекса происходит без образования ковалентных связей, а осуществляется за счет более слабых, но и более специфических типов взаимодействий, таких, как водородные связи, солевые мостики, гидрофобные силы и плотная упаковка атомов.
|
|
|


