 |
Ферментативная кинетика. Модель Михаэлиса-Ментен. График Лайнуивера-Бэрка в двойных обратных координатах. Ингибирование. Обратимое ингибирование
|
|
|
|
Ферментативная кинетика
Модель Михаэлиса-Ментен

Рис. 14
Кинетические свойства многих, но не всех ферментов можно объяснить в рамках модели Михаэлиса-Ментен. Согласно этой модели, субстрат S связывается с ферментом E с константой скорости k1. Образующийся фермент-субстратный комплекс E-S может либо диссоцировать на E и S с константой k2, либо с константой скорости k3 превратиться в продукт P и свободный фермент.
В модели предполагается, что продукт не может обратно превращаться в субстрат, что справедливо для ранних стадий реакции, когда концентрация продукта низка. Скорость реакции V связана с концентрацией субстрата [S] следующим соотношением V=Vmax([S]/([S]+Km)), где Vmax — максимальная скорость реакции, достигающаяся в том случае, когда все молекулы фермента связаны с субстратом, а Km=(k2+k3)/k1.
Km, константа Михаэлиса, численно равна концентрации субстрата, при которой скорость реакции составляет половину максимальной величины.
Km — это мера сродства данного субстрата к ферменту (в том случае, когда k3 < < k2), которое, в свою очередь, отражает прочность связывания субстрата с активным центром. График зависимости V от [S] представляет собой гиперболу.
График Лайнуивера-Бэрка в двойных обратных координатах
Существует альтернативный способ представления уравнения Михаэлиса-Ментен — с помощью графика двойных обратных координат, предложенного Лайнуивером и Бэрком.
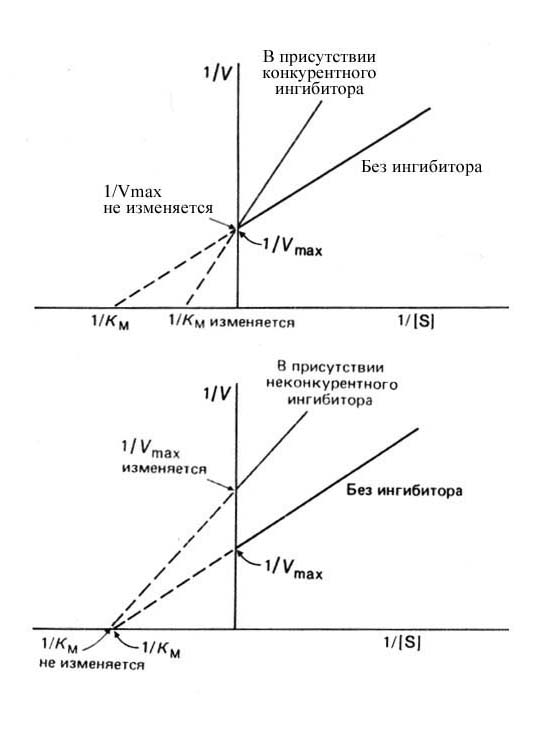
Рис. 15
Перепишем уравнение в виде 1/V=Km/(Vmax[S])+1/Vmax.
Если построить зависимость 1/V от 1/[S], то получим прямую с наклоном Km/Vmax, отсекающую от оси 1/V отрезок длиной 1/Vmax. Использование такой записи уравнения Михаэлиса-Ментен позволяет легко определить значения величин Vmax и Km.
|
|
|
Ингибирование
Известны различные низкомолекулярные соединения, которые могут тормозить ферментативные реакции. Такие соединения называют ингибиторами.
Ингибирование Необратимое Обратимое конкурентное неконкурентное бесконкурентное
Обратимое ингибирование
При определенных условиях ингибитор может быть легко отделен от фермента.
Конкурентное ингибирование
В этом случае вещество, по своей структуре близкое к обычному субстрату Ф., соединяется с активным центром Ф., но не может прореагировать с ним. Находясь здесь, оно преграждает доступ к активному центру любой молекуле настоящего субстрата. В результате связывания конкурентного ингибитора с активным центром Ф. падает концентрация Е-S-комплексов и, следовательно, уменьшается скорость реакции. Ингибитор обычно в продукт не превращается.
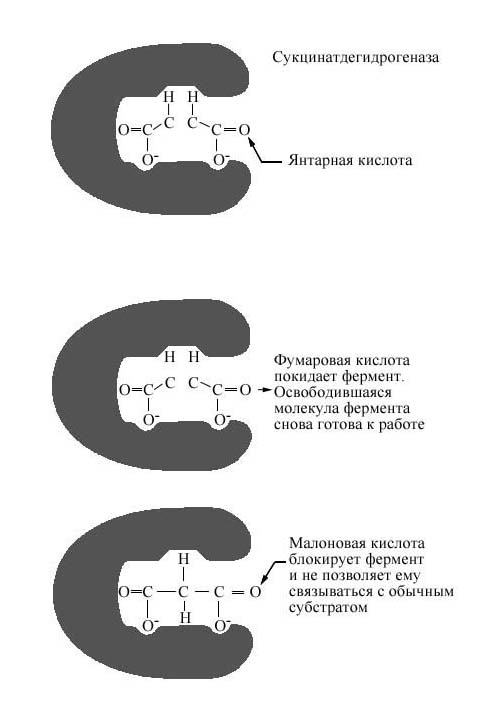
Рис. 16 Пример конкурентного ингибирования. Фермент сукцинатдегидрогеназа катализирует превращение янтарной кислоты в фумаровую, Конкурентное ингибирование фермента малоновой кислотой.
Поскольку в этом случае ингибитор и субстрат конкурируют за место в активном центре Ф., эту форму ингибирования называют конкурентным ингибированием. Оно обратимо, т. к. при увеличении концентрации субстрата скорость реакции возрастает.
Неконкурентное ингибирование
Ингибиторы этого рода не родственны по своей структуре субстрату данного Ф.; в образовании комплекса с ингибитором участвует в этом случае не активный центр, а какая-нибудь другая часть его молекулы.

Рис. 17 Проявление неконкурентного ингибирования: нормальная и ненормальная реакции.
Образование комплекса влечет за собой изменение глобулярной структуры Ф., и, хотя настоящий субстрат при этом к Ф. все же присоединяется, катализ тем не менее оказывается невозможным. Поскольку связывание с неконкурентным ингибитором не мешает ферменту образовывать Е-S-комплекс, этот ингибитор не понижает концентрацию таких комплексов, а влияет на эффективность превращения субстрата в продукт.
|
|
|
P. S. Конкурентный и неконкурентный ингибиторы можно отличить друг от друга по тому, как в их присутствии изменяются кинетические свойства ферментной системы. Это легче всего проиллюстрировать с помощью графика Лайнуивера-Бэрка (см. рис. 14). Если поведение Ф. подчиняется уравнению Михаэлиса-Ментен, то это свойство Ф. будет сохраняться и в присутствии ингибитора — как первого, так и второго типа. Однако при добавлении конкурентного и неконкурентного ингибитора график в двойных обратных координатах будет изменяться, причем в зависимости от типа ингибитора характер изменения будет различным.
|
|
|


