 |
Определение постоянной Больцмана
|
|
|
|
Цель работы:1- экспериментально подтвердить зависимость давления газа от концентрации молекул при постоянной температуре газа; 2 - определить постоянную Больцмана.
Методика эксперимента
Давление газа пропорционально концентрации молекул n и термодинамической температуре Т газа [см. формулу (1.8)]:
 ,
,
где k - постоянная Больцмана.
Если изменить концентрацию молекул на величину D n при неизменной температуре газа, то давление газа изменится на величину D p:
 .
.
Изменение давления газа при постоянной температуре пропорционально изменению концентрации молекул газа.
Целью работы является экспериментальное подтверждение зависимости (1.34) при Т = const и определение постоянной Больцмана.
Используемая в лабораторной работе установка (рис. 1.8) состоит из сосуда С, объем которого ² V C² известен; шприца Ш; U-образного водяного манометра М и крана К. Резиновый шланг 1 соединяет сосуд с одним из колен манометра, шланг 2 соединяет шприц (через кран) с сосудом.
 Рукоятка крана имеет три положения: в положении "1² полости сосуда и шприца сообщаются друг с другом и с атмосферой; в положении ²2² связь сосуда и шприца с атмосферой прекращается; в положении ²3² происходит полная изоляция сосуда и восстанавливается связь шприца с атмосферой.
Рукоятка крана имеет три положения: в положении "1² полости сосуда и шприца сообщаются друг с другом и с атмосферой; в положении ²2² связь сосуда и шприца с атмосферой прекращается; в положении ²3² происходит полная изоляция сосуда и восстанавливается связь шприца с атмосферой.
В начальный момент времени рукоятку крана ставят в положении ²1², в шприц из атмосферы набирают определенный объем ² V Ш² воздуха. При этом температура Т воздуха в сосуде и шприце равна температуре воздуха в аудитории. Давления воздуха в шприце и в сосуде будут равны атмосферному р = р А. Разность уровней жидкости в коленах манометра равна нулю. Число молекул D N, находящихся в объеме ² V Ш² шприца:
|
|
|
 , (1.17)
, (1.17)
где n - число молей воздуха; N А – число Авогадро; V ш,0 – объем, который занимал бы воздух в шприце при нормальных условиях; V m,0 = 22,4 л – объем одного моля газа при нормальных условиях (см. приложение).
Определим, каким был бы объем воздуха в шприце при нормальных условиях. Для этого запишем уравнение состояния газа [см. формулу (1.6)]:
 , отсюда
, отсюда  ,
,
где р 0 = 1,01×105 Па; Т 0 = 273К – давление и температура газа при нормальных условиях.
Подставив последнее выражение в уравнение (1.17), получим:
 . (1.18)
. (1.18)
Повернув рукоятку крана в положение ²2² и, переводя газ из шприца в сосуд, увеличиваем концентрацию газа в сосуде на величину D n:
 . (1.19)
. (1.19)
Подставив формулу (1.18) в выражение (1.19), получим:
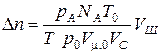 , (1.20)
, (1.20)
где р А - атмосферное давление; р 0 = 760 мм Hg = 1,01×105 Па; Т 0 = 273К;
N А = 6,02×1023 моль-1; Т - температура воздуха в аудитории; V m,0 = 22,4×10-3 м3;
V С – объем сосуда; V Ш – объем воздуха, набираемого шприцем.
Обозначим  , (1.21)
, (1.21)
тогда формула (1.20) будет иметь вид  . (1.22)
. (1.22)
Изменение концентрации молекул в сосуде вызовет изменение давления (D р = D n k T) на величину D р. В связи с этим высота столбика жидкости в колене манометра, соединенном с сосудом, уменьшится, а в другом – увеличится. Разность давлений найдем по формуле:
 , (1.23)
, (1.23)
где  - разность уровней жидкости в коленах манометра; r = 103 кг/м3 – плотность воды; g = 9,81 м/с2 – ускорение свободного падения тел.
- разность уровней жидкости в коленах манометра; r = 103 кг/м3 – плотность воды; g = 9,81 м/с2 – ускорение свободного падения тел.
в формуле (1.23) обозначим B = r× g, (1.24)
тогда: D р = В ×D h. (1.25)
Порядок выполнения работы
1. Поставить кран К в положение ²1². Набрать в шприц воздух объемом V ш = 10 см3. Перевести кран в положение ²2².
2. Ввести воздух из шприца в сосуд. Рукоятку крана перевести в положение ²3², повернув ее по часовой стрелке на 90°.
3. Подождать 1 – 1,5 минуты, пока прекратится перемещение жидкости в коленах манометра. Измерить по шкале манометра М высоты уровней жидкости h 1 и h 2. Результаты измерений занести в таблицу 1.1.
|
|
|
4. Оставить кран в положении ²3². Набрать в шприц воздух объемом V ш = 10 см3. Перевести кран в положение ²2². Ввести воздух из шприца в сосуд. Вернуть кран в положение ²3². Таким образом, в сосуд уже будет введено 20 см3 воздуха.
5. Подождать 1 – 1,5 минуты, пока прекратится перемещение жидкости в коленах манометра. Измерить по шкале манометра М высоты уровней жидкости h 1 и h 2. Результаты измерений занести в таблицу 1.1.
6. Повторить пункты 4, 5 два раза. При этом в сосуд уже будет введено соответственно 30 см3, затем 40 см3 воздуха.
7. По шкале барометра определите величину атмосферного давления р.
8. По шкале термометра определите температуру воздуха в аудитории Т.
Таблица 1.1
| V Ш,м3 | h 1, мм | h 2, мм | D h, м | р А, мм Hg | Т, К | V C, м3 | А, м-6 | В кг/м2×с2 | D n, м-3 | D р, Па | k, Дж/К |
| 10×10-6 | 2,35×10-3 | ||||||||||
| 20×10-6 | |||||||||||
| 30×10-6 | |||||||||||
| 40×10-6 |
Обработка результатов измерений
1. Вычислить постоянные А и В по формулам (1.21) и (1.24).
2. Используя формулы (1.22) и (1.25), вычислить для каждого из четырех измерений величины D n и D р. Результаты вычислений записать в таблицу 1.1.
3.  Построить график зависимости D р = f (D n). Прямую, проходящую через ноль, проводим усредненно.
Построить график зависимости D р = f (D n). Прямую, проходящую через ноль, проводим усредненно.
4. Определить по графику
 .
.
5. Вычислить постоянную Больцмана  .
.
6. Сравнить полученное значение постоянной Больцмана с табличным.
7. Сделать вывод по проделанной работе.
Контрольные вопросы и задания
1. Запишите уравнение Клайперона-Менделеева для произвольной массы газа и для одного моля.
2. Чему равно численное значение универсальной газовой постоянной?
3. Запишите уравнение молекулярно-кинетической теории идеального газа.
4. Запишите формулу, выражающую связь между термодинамической температурой газа и средней кинетической энергией теплового движения молекул.
5. Запишите формулу, выражающую связь постоянной Больцмана с универсальной газовой постоянной и числом Авогадро.
6. Какой физический смысл имеет постоянная Больцмана?
7. Как давление газа, находящегося при постоянной температуре, зависит от концентрации молекул?
Лабораторная работа
|
|
|
|
|
|


