 |
Теплота, сообщаемая системе, расходуется на изменение внутренней энергии системы и на совершение системой работы против внешних сил.
|
|
|
|
При осуществлении в системе произвольного процесса, в результате которого она вновь пришла бы в исходное состояние, изменения внутренней энергии не происходит. Математически это выражается следующим образом:  . Тогда, согласно первому началу термодинамики: А = Q,то есть вечный двигатель первого рода - периодически действующий двигатель, который совершал бы работу большую, чем сообщенная ему извне энергия, невозможен.
. Тогда, согласно первому началу термодинамики: А = Q,то есть вечный двигатель первого рода - периодически действующий двигатель, который совершал бы работу большую, чем сообщенная ему извне энергия, невозможен.
Для работы, которая совершается при расширении или сжатии газа, заключенного в сосуд с подвижным поршнем, уравнение будет иметь следующий вид:
d А = р dV.
формула (3.4) справедлива не только для газа и жидкости, но и для твердых тел при их сжатии или растяжении под действием внешних сил, равномерно распределенных по поверхности тела.
Применение первого начала термодинамики
к изопроцессам
Изопроцессы – это процессы, при которых один из основных параметров состояния системы остается постоянным.
Изохорный (изохорический) процесс (V = const). При изохорном процессе газ не совершает работы над внешними телами, поэтому:
d А = р dV = 0.
Вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии, первое начало термодинамики примет вид:
d Q = dU.
Диаграмма этого процесса – изохора в координатах р, V (рис. 3.1) изображается прямой, параллельной оси ординат.
Изобарный (изобарический) процесс (р = const). При изобарном процессе работа газа при увеличении объема от V 1 до V 2 равна
А =  = р (V 2- V 1)
= р (V 2- V 1)

и определяется площадью прямоугольника на рис. 3.2.
Тепло, переданное системе, идет на увеличение ее внутренней энергии и на совершение работы над внешними телами. Первое начало термодинамики запишется так:
d Q = dU + р dV.
Изотермический процесс (Т = const). Поскольку температура постоянна, следовательно, внутренняя энергия идеального газа не изменяется (см. стр. 16, 17). Отсюда следует, что все тепло, переданное системе, идет на совершение им работы против внешних сил. Первое начало термодинамики для изотермического процесса
|
|
|
d Q = d А = р dV.
Адиабатический процесс. Адиабатическим называется процесс, при котором отсутствует теплообмен(d Q = 0)между системой и окружающей средой. К таким процессам можно отнести все быстропротекающиепроцессы: быстрое сжатие или расширение газа (распространение звука в среде, двигатель внутреннего сгорания, холодильные установки).
При адиабатическом процессе первое начало записывается в виде:
d А + dU = 0,
или
d А = - dU, (3.11)
то есть внешняя работа совершается за счет убыли внутренней энергии системы.
Теплоемкость вещества
Теплоемкость удельная и молярная. Эксперименты показали, что количество тепла d Q, переданное телу или отнятое у него, пропорционально массе m тела и изменению его температуры dТ:
d Q = с m dТ,
где с – удельная теплоемкость вещества, следовательно, она выразится так:
 ,
,
то есть удельная теплоемкость вещества – величина, равная количеству теплоты, необходимой для нагревания 1 кг вещества на 1 К (Дж/кг×К).
Молярная теплоемкость вещества – величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К:
 ,
,
где  – количество вещества.
– количество вещества.
Удельная теплоемкость связана с молярной теплоемкостью соотношением: С = с× m.
Различают теплоемкость при постоянном давлении СP и теплоемкость при постоянном объеме СV.
Первое начало термодинамики при постоянном объеме для одного моля газа:
С dТ = dU m + р dV m.
Если процесс изохорный, то сообщаемая газу теплота идет только на увеличение его внутренней энергии:
 .
.
Поскольку изменение внутренней энергии [см. формулу (1.14)]одного моля газа можно выразить формулой  , то
, то
|
|
|
 .
.
Если газ нагревается при постоянном давлении, то теплоемкость моля газа
 +
+ 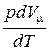 .
.
Учитывая то, что внутренняя энергия газа не зависит ни от давления, ни от объема, а определяется только температурой и всегда равна СV, продифференцировав уравнение Клапейрона-Менделеева по Т (р V m = RТ,  ), получим:
), получим:
СP = СV +R. (3.1)
выражение (3.1) называется уравнением Майера. Оно показывает, что СP всегда больше СV на величину молярной газовой постоянной. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления можно обеспечить только увеличением объема газа.
Это уравнение можно выразить также через число степеней свободы
 .
.
При рассмотрении термодинамических процессов важно знать характерное для каждого газа соотношение СP к СV:
 .
.
 Из этих формул следует, что молярные теплоемкости определяются лишь числом степеней свободы и не зависят от температуры. Однако это утверждение справедливо в широком интервале температур только для одноатомных газов. Для двухатомных молекул теплоемкость зависит от температуры. Так из качественной экспериментальной зависимости молярной теплоемкости водорода вытекает, что СV следующим образом зависит от температуры (рис. 3.3).
Из этих формул следует, что молярные теплоемкости определяются лишь числом степеней свободы и не зависят от температуры. Однако это утверждение справедливо в широком интервале температур только для одноатомных газов. Для двухатомных молекул теплоемкость зависит от температуры. Так из качественной экспериментальной зависимости молярной теплоемкости водорода вытекает, что СV следующим образом зависит от температуры (рис. 3.3).
Такую зависимость можно объяснить тем, что при низких температурах наблюдается только поступательное движение молекул газа. При комнатных – добавляется вращение, а при очень высоких – к этим двум видам движения добавляются еще и колебательные движения молекул.
Уравнение Пуассона. Политропный процесс
Рассмотрим уравнение, связывающее параметры газа при адиабатическом процессе. Поскольку при адиабатическом процессе d Q = 0, то первое начало термодинамики для одного моля газа примет вид:
СV dТ + р dV 0 = 0. (3.2)
Напишем уравнение Клапейрона-Менделеева: рV 0 = RТ, выразим отсюда давление: р = RТ / V 0,и подставимего в уравнение (3.2):
 .
.
Учитывая, что R = СP - СV [см. (3.1)], получим:
 .
.
Так как  [см. (3.22)], то последнее равенство можно записать в виде:
[см. (3.22)], то последнее равенство можно записать в виде:
 .
.
Проинтегрировав это выражение, получим:

или  .
.
Поскольку величина, логарифм которой постоянен, тоже постоянная, то:
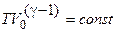 . (3.3)
. (3.3)
выражение (3.3) является уравнением адиабатического процесса,также ононазывается уравнением Пуассона.
|
|
|
Для перехода к другим переменным, например р и Т или р и V 0, исключим из уравнения (3.3) температуру или объем с помощью уравнения Клапейрона-Менделеева (1.8), получим соответственно:
 ,
,
 .
.
 В этих уравнениях безразмерная величина g называется показателем адиабаты, адиабатической постоянной или коэффициентом Пуассона. Диаграмма адиабатического процесса (адиабата) в координатах давления и объема изображена на рис. 3.4
В этих уравнениях безразмерная величина g называется показателем адиабаты, адиабатической постоянной или коэффициентом Пуассона. Диаграмма адиабатического процесса (адиабата) в координатах давления и объема изображена на рис. 3.4
Адиабата  ,падает круче, чем изотерма
,падает круче, чем изотерма  . Это объясняется тем, что при адиабатическом сжатии 1 - 3 увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом процессе, но и повышением температуры.
. Это объясняется тем, что при адиабатическом сжатии 1 - 3 увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом процессе, но и повышением температуры.
Все рассмотренные выше процессы: изохорный, изобарный,, изотермический, адиабатический имеют одну общую особенность – каждый из них происходит при постоянной теплоемкости. Изохорный - при СV, изобарный – при СP, при изотермическом процессе теплоемкость равна ±¥, а в адиабатическом теплоемкость равна нулю.
Процесс, в котором теплоемкость остается постоянной, называется политропным. Исходя из первого начала термодинамики[см. (3.1), (3.2), (3,3)] при условии постоянства теплоемкости (C = const) можно вывести уравнение политропы:
 ,
,
где  – безразмерная постоянная величина называется показателем политропы. Четырем процессам, о которых говорилось выше, соответствуют различные значения показателя политропы.
– безразмерная постоянная величина называется показателем политропы. Четырем процессам, о которых говорилось выше, соответствуют различные значения показателя политропы.
Например, при: n = 0 получим изобарный процесс (р = const);
n = 1 – изотермический процесс(pV = const);
n = ± ¥ - изохорный процесс (V = const);
n =g - адиабатный процесс (С = 0).
Работа газа при изопроцессах
Изохорный процесс [см. формулу (1.5)]. При этом процессе работа газа равна нулю, поскольку V = const,тоd А = 0.
Изобарный процесс [см. формулу (1.4)]. При изменении объема газа от V 1 до V 2 совершается работа
А =  = р (V 2 - V 1).
= р (V 2 - V 1).
Если использовать уравнение Клапейрона-Менделеева для выбранных нами двух состояний, то
 ;
;  ,
,
откуда  ,
,
тогда выражение для работы изобарного расширения примет вид:
 .
.
Из этого выражения вытекает физический смысл молярной газовой постоянной: если разность температур равна 1 К, то для 1 моля газа R=A, то есть газовая постоянная Rчисленно равнаработе изобарного расширения 1 моля идеального газа при нагревании его на 1 К.
|
|
|
Изотермический процесс. Изотермический процесс описывается законом Бойля-Мариотта[см. формулу (1.1)].При изотермическом расширении газа работа равна:
А = 
 =
= 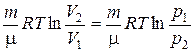 .
.
Это и есть работа газа против внешних сил, причем вся теплота, сообщаемая газу, расходуется на совершение работы.
Адиабатический процесс. При адиабатическом процессе работа совершается за счет внутренней энергии. Если газ адиабатически расширяется от V 1 до V 2, то его температура уменьшается от Т 1 до Т 2.
Тогда выражение для работы расширения идеального газа можно записать в таком виде:
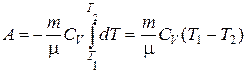 .
.
Для того, чтобы перейти к другой переменной V,воспользуемся уравнением Клапейрона-Менделеева, а также тем, что
СV =  .
.
В результате получим выражение для работы при адиабатическом процессе для любой массы газа:
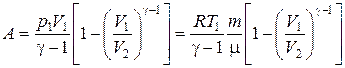 .
.
 Работа, совершаемая газом при адиабатическом расширении 1 ® 2, определяется площадью под кривой от точки 1 до точки 2 (рис. 3.5).
Работа, совершаемая газом при адиабатическом расширении 1 ® 2, определяется площадью под кривой от точки 1 до точки 2 (рис. 3.5).
Видно, что работа, которая совершается при адиабатическом процессе меньше, чем при изотермическом. Это объясняется тем, что при адиабатическом расширении происходит охлаждение газа, тогда как при изотермическом – температура поддерживается постоянной за счет притока извне эквивалентного количества теплоты.
Обратимые и необратимые процессы. Циклы
Для описания термодинамических процессов одного первого начала термодинамики, которое устанавливает связь между теплотой, работой и изменением внутренней энергии, недостаточно, поскольку первое начало термодинамики не определяет направление тепловых процессов, а только выражает закон сохранения и превращения энергии. Ограниченность первого начала термодинамики привела к необходимости расширения теоретических основ термодинамики. Но для того, чтобы перейти к обсуждению сути и формулировки второго начала термодинамики, расширим свои представления о термодинамических процессах, в частности, познакомимся с циклами (круговыми процессами),обратимымиинеобратимымипроцессами, а также с понятием энтропии.
Круговым процессом или циклом называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное (рис. 3.6).  На диаграмме процессов цикл изображается замкнутой кривой. Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1®2) и сжатия (2®1). Работа расширения газа положительна (dV > 0, площадь 1а2 V 2 V 11), работа сжатия – отрицательна (dV < 0, площадь 2б1 V 1 V 2 2).
На диаграмме процессов цикл изображается замкнутой кривой. Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1®2) и сжатия (2®1). Работа расширения газа положительна (dV > 0, площадь 1а2 V 2 V 11), работа сжатия – отрицательна (dV < 0, площадь 2б1 V 1 V 2 2).
|
|
|
Работа, совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой. Если цикл протекает по часовой стрелке, то он называется прямым (совершается положительная работа). Если цикл протекает против часовой стрелки, то совершается отрицательная работа, цикл называется обратным.
Прямой цикл используется в тепловых двигателях (в теплоотдатчиках), а обратный - в холодильных установках (в теплоприемниках).
В результате кругового процесса система возвращается в исходное состояние, следовательно, полное изменение внутренней энергии газа равно нулю. Поэтому первое начало термодинамики для кругового процесса
Q = D U + А = А.
Работа, совершаемая за цикл, равна количеству полученной извне теплоты. Однако система может и отдавать теплоту, поэтому
Q = Q 1 - Q 2,
где Q 1 – количество теплоты, полученное системой, Q 2 - количество теплоты, отданное системой. Термический коэффициент полезного действия (к.п.д.) для кругового процесса выражается следующим образом:
 .
.
Из определения кпд следует, что он не может быть больше единицы. например, кпд паровой турбины – 0,2; дизеля – 0,35.
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении. Причем, если такой процесс происходит сначала в прямом, а затем в обратном направлении, то в окружающей среде и в самой системе не происходит никаких изменений.
Любой другой процесс, который не удовлетворяет этим условиям, называется необратимым. Всякий обратимый процесс является равновесным.
Примером обратимого процесса (до некоторой степени) могут служить незатухающие колебания, которые совершает в вакууме тело, подвешенное на абсолютно упругой пружине: изменения состояния системы связано только с изменением ее конфигурации и скорости движения, при этом механические колебания не вызывают теплового движения частиц. Примером необратимого процесса в механике является торможение тела под действием силы трения: энергия механического движения тела уменьшается и расходуется на увеличение теплового движения частиц самого тела и окружающей среды.
Примерами необратимых процессов в молекулярной физике могут служить расширение газа в пустоту и переход теплоты от более нагретого тела к менее нагретому. Однако надо всегда помнить, что обратимые процессы – это идеализация. Реальные процессы всегда сопровождаются диссипацией энергии. Но изучение обратимых процессов важно, поскольку обратимые процессы являются наиболее экономичными.
|
|
|


