 |
Определение отношения теплоемкостей
|
|
|
|
газов 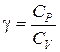 методом клемана - дезорма
методом клемана - дезорма
Цель работы: определить отношение теплоемкостей газов (коэффициент Пуассона) методом Клемана – Дезорма.
Методика эксперимента
Общая схема установки представлена на рис. 3.7. Стеклянный баллон Б соединен с манометром М, измеряющим давление в сосуде. Изменение давления может осуществляться насосом Н, имеющим три рабочих положения, которые задействуются с помощью переключателя П.
 Установив переключатель П в положение ²насос², накачиваем воздух до некоторого давления, превышающего атмосферное. Через 1 – 2 минуты температура воздуха в баллоне становится равной температуре окружающей среды. Это состояние газа характеризуется давлением p 1, температурой Т 1 и удельным объёмом
Установив переключатель П в положение ²насос², накачиваем воздух до некоторого давления, превышающего атмосферное. Через 1 – 2 минуты температура воздуха в баллоне становится равной температуре окружающей среды. Это состояние газа характеризуется давлением p 1, температурой Т 1 и удельным объёмом  (V – объём баллона, m 1 – масса газа, находящегося в нем).
(V – объём баллона, m 1 – масса газа, находящегося в нем).
Давление p 1 определяется по формуле  ,
,
где p 0 – атмосферное давление; D p 1 – добавочное давление, измеряемое разностью уровней в манометре М.
Затем переводим переключатель в положение ²Открыто² и как только уровни в манометре сравняются - в положение ²Закрыто². Выход воздуха происходит очень быстро и, пренебрегая в первом приближении передачей тепла через стенки сосуда, процесс расширения воздуха можно считать адиабатическим. В сосуде устанавливается давление p, равное атмосферному p 0. Газ имеет удельный объём  (m 2 – масса газа, оставшегося в баллоне) и температуру Т 2.
(m 2 – масса газа, оставшегося в баллоне) и температуру Т 2.
Для адиабатического процесса справедливо уравнение Пуассона
 или
или  . (3.11)
. (3.11)
напомним, что V 1 и V 2 - объёмы единицы массы газа.
Через 1 – 2 минуты газ нагреется до температуры окружающей среды Т 2. Его давление в баллоне будет  , где D p 2 добавочное давление, измеряемое разностью уровней в манометре. удельный объём останется равным V 2, так как масса и объём газа не меняются. Сравнивая конечное состояние с начальным, видим, что температура в этих состояниях одинакова. Запишем для изотермического процесса закон Бойля-Мариотта
, где D p 2 добавочное давление, измеряемое разностью уровней в манометре. удельный объём останется равным V 2, так как масса и объём газа не меняются. Сравнивая конечное состояние с начальным, видим, что температура в этих состояниях одинакова. Запишем для изотермического процесса закон Бойля-Мариотта
|
|
|
 или
или  . (3.12)
. (3.12)
Решая [1] систему уравнений (3.11) и (3.12), найдем g:
 .
.
Добавочные давления D р 1 и D р 2 определяются по формулам:
 ;
;  ,
,
где r - плотность воды, h 1 и h 2 – разность уровней воды в коленах манометра.
Окончательно получаем расчетную формулу для нашего опыта
 . (3.13)
. (3.13)
Таким образом, измеряя разности уровней воды в коленах манометра h 1 и h 2 , можно найти отношение теплоемкостей 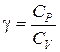 .
.
Примечание. При выполнении работы можно варьировать величину h 1, соответственно будет изменяться и h 2. Однако слишком большие значения h 1 брать нельзя, так как при этом в манометре возникают колебания столбика воды большой амплитуды.
Порядок выполнения работы
1. Включить насос в сеть 220 В.
2. Поставить переключатель П в положение ²Насос² и накачать воздух в баллон Б до разности уровней воды в коленах манометра М приблизительно 8 – 10 см (см. примечание выше).
3. Перекрыть сообщение между баллоном Б и насосом Н, поставив переключатель П в положение ²Закрыто².
4. Подождать 2 – 3 минуты пока разность уровней воды в коленах манометра не перестанет меняться. Измерить h 1 (разность уровней воды в коленах манометра) по шкале линейки. Записать результат измерения в таблицу 3.1.
5. Поставить переключатель П в положение ²Открыто², как только уровни воды в коленах манометра сравняются, сразу перевести его в положение ²Закрыто².
6. Выждав 2 – 3 минуты (пока давление в манометре перестанет изменяться), снять отсчет h 2 - установившейся разности уровней воды в коленах манометра. Записать результат измерения в таблицу 3.1.
7. Повторить пункты 2 – 6 пятикратно.
Таблица 3.1
| h 1 | h 2 | g i | gтеор | gэксп | Dg |
|
|
|
Обработка результатов измерений
1. Рассчитать значения коэффициента Пуассона по формуле (3.13) для всех пяти измерений.
2. Вычислить теоретическое значение коэффициента Пуассона (gтеор) по формуле  .
.
3. В качестве результата эксперимента (gэксп) выбрать наиболее близкое к теоретическому значению из пяти, рассчитанных в п. 1.
4. Для gэксп рассчитать относительную погрешность по формуле
 .
.
5. Определить абсолютную погрешность по формуле Dg = gэкспe.
6. Записать результат экспериментального определения коэффициента Пуассона g = (gэксп ± Dg)
7. Сделать вывод по проделанной работе.
Контрольные вопросы и задания
1. Сформулируйте первое начало термодинамики.
2. Как определяется внутренняя энергия системы? Запишите выражение для внутренней энергии идеального газа.
3. Что такое число степеней свободы? Как определяется это число для одно-, двух- и трехатомных молекул?
4. Что называется удельной и молярной теплоёмкостями?
5. Какие физические величины обозначаются знаками СР и СV? Каким уравнением описывается связь между ними? Какие законы используются при выводе этого уравнения?
6. Какой процесс называется изотермическим? Изобарическим? Изохорическим? Адиабатическим? Запишите уравнения состояния для этих процессов.
7. Запишите первое начало термодинамики для всех изопроцессов и для адиабатического процесса.
Лабораторная работа
|
|
|


