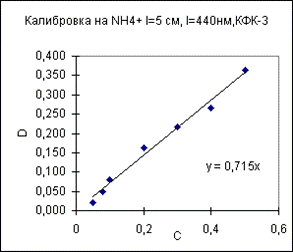
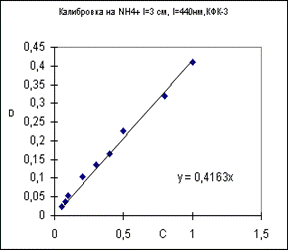
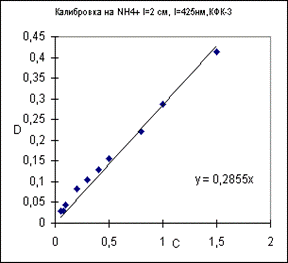
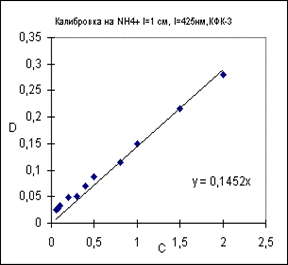
|
Определение растворенного кислорода
|
|
|
|
Принцип метода. Метод основан на взаимодействии в щелочной среде гидроокиси марганца с растворенным в воде кислородом. Гидроокись марганца, количественно связывая растворенный в воде кислород, переходит в нерастворимое соединение четырехвалентного марганца коричневого цвета. При подкислении раствора в присутствии избытка йодистого калия образуется под, количество которого эквивалентно содержанию растворенного кислорода и учитывается титрованием раствором тиосульфата:
Мп2+ + 2ОН-—> Мп(ОН)2 (белый);
2Мп(ОН)2 + О2 —> 2МпО(ОН)2 (коричневый);
МпО(ОН)2 + 4Н+ + 2I- —> Мп2+ + I2↑ + ЗН2О;
I2 +2S2O32- —> 2 I - + S4O62-
Характеристика метода. Минимально определяемая концентрация 0,05 мгО2/дм3. Относительное стандартное отклонение U при концентрациях 7–10мг О2/дм3 составляет 0,3% (п=20).
МУ РД 52.24-419-95.
Формы миграции. Растворенный кислород в поверхностных водах находится в виде молекул О2. Растворимость его растет с понижением температуры и минерализации, с повышением давления. Величину растворимости кислорода при нормальном давлении называют нормальной концентрацией. Насыщение воды кислородом, соответствующее нормальной концентрации, принимается равным 100%. В случае высокой интенсивности фотосинтеза вода может быть значительно пересыщена кислородом. При этом часть его может переходить в газообразную форму.
Содержание в поверхностных водах. В поверхностных водах содержание растворенного кислорода может колебаться от О до 14мг/дм3 и подвержено значительным сезонным и суточным колебаниям. Суточные колебания зависят от соотношения интенсивности процессов его продуцирования и потребления, могут достигать 2,5 мг/дм3 и более. В речных водах наиболее высокие концентрации наблюдаются обычно в осеннее время, наиболее низкие – зимой, когда в результате образования ледяного покрова прекращается поступление кислорода из атмосферы.
|
|
|
Дефицит кислорода чаще наблюдается в эвтрофных водоемах, а также в водоемах, содержащих большое количество загрязняющих и гумусовых веществ.
Свойства, цели наблюдения. Кислородный режим оказывает глубокое влияние на жизнь водоема. Минимальное содержание растворенного кислорода, обеспечивающее нормальное развитие рыб, составляет около 5 мгО2/дм3. Понижение его до 2 мг/дм3 вызывает массовую гибель рыб (ПДКвр=2,0 мгО2/дм3). Неблагоприятно сказывается на их состоянии и пересыщение воды кислородом.
Определение кислорода в поверхностных водах включено в программы наблюдений с целью оценки условий обитания гидробионтов, в том числе рыб, косвенной характеристикой качества воды, интенсивности процессов продуцирования и деструкции органических веществ, самоочищения водоемов и т.д. Концентрацию кислорода выражают либо в миллиграммах на дециметр кубический, либо в процентах – % насыщения.
Иодометрическое определение. Кислород является неустойчивым компонентом, определение которого должно производиться на месте отбора проб.
Принцип метода. Титриметрический метод йодометрического определения основан на взаимодействии в щелочной среде гидроокиси марганца с растворенным в воде кислородом. Гидроокись марганца, количественно связывая растворенный в воде кислород, переходит в нерастворимое соединение четырехвалентного марганца коричневого цвета. При подкислении раствора в присутствии избытка йодистого калия образуется под, количество которого эквивалентно содержанию растворенного кислорода и учитывается титрованием раствором тиосульфата:
Мп2+ + 2ОН-—> Мп(ОН)2 (белый);
2Мп(ОН)2 + О2 —> 2МпО(О Н)2 (коричневый);
|
|
|
МпО(ОН)2 + 4Н+ + 2I- —> Мп2+ + I2↑ + ЗН2О;
I2 +2S2O32- —> 2 I - + S4O62-
Характеристика метода. Минимально определяемая концентрация 0,05 мгО2/дм3. Относительное стандартное отклонение U при концентрациях 7–10мг О2/дм3 составляет 0,3% (п=20). Продолжительность определения единичной пробы с учетом ее отстаивания 40 мин. Серия из 6 проб определяется в течение 1,5ч.
Ход работы
I. Определение точной вместимости кислородных склянок и склянок БПК5
I) Калибровка кислородных склянок
Склянки для определения О2 тщательно вымыть снаружи и изнутри, высушить и взвесить вместе с пробкой на технических весах, с точностью до 0,01 г.
Для измеренияобъёма сухую чистую склянку наполнить дистиллированной водой до краёв и закрыть стеклянной пробкой так, чтобы под пробкой не оставалось пузырьков воздуха.
Обтереть склянку досуха и снова взвесить с точностью до 0,01 г.
Разность в весе даст массу воды в объёме склянки, которую для перевода на объём, следует разделить при температуре воды 15оС на 0,998, при 20оС – на 0,997, при 25оС – на 0,996.
| Масса сухой склянки, г | Масса склянки с водой, г | Масса воды в объеме склянки, см3 | Температура, °С | Объем воды, см3 |
II) Фиксирование растворенного кислорода
1) Отобранной пробой заполнить кислородную склянку, с помощью сифона, предварительно ее ополоснув 2-3 раза;
2) в склянку пипетками поместить по 1(2) см3 растворов хлорида марганца или сульфата марганца и KI+NaOH;
3) склянку закрыть пришлифованной пробкой и перемешать переворачиванием 15-20 раз;
4) поставить склянку на 10 мин. в темное место.
III) Определение точной концентрации раствора тиосульфата натрия (Na2S2O3):
1) В коническую колбу для титрования внести 10 см3 0,02 н р-ра дихромата калия;
2) добавить 90 см3 дистиллированной воды;
3) добавить 1 г сухого иодида калия;
4) добавить 10 см3 раствора соляной кислоты (2:1) или серной кислоты (1:4) (Колбу закрыть крышкой!);
5) поставить склянку в темное место на 5-10 мин.;
6) титровать полученный раствор до светло-желтой окраски;
7) добавить 1 см3 крахмала;
8) оттитровать раствор до исчезновения окраски;
9) определение повторить (расхождения между результатами не должно быть более 0,05 см3);
10) рассчитать точную концентрацию тиосульфата натрия по формуле:
|
|
|
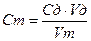 , где
, где
С т – концентрация раствора тиосульфата натрия, моль/дм3-эквивалента;
С д – концентрация раствора дихромата калия, моль/дм3-эквивалента;
V т – объём раствора тиосульфата натрия, пошедший на титрование, см3 (среднее из двух определений);
V д – объём раствора дихромата калия, взятый для определения, см3.
IV) Определение концентрации растворенного кислорода
1) Достать кислородную склянку (с зафиксированным кислородом) из темного места;
2) добавить в склянку 5-10 см3 р-ра серной кислоты (1:4) или соляной кислоты (2:1);
3) закрыть склянку стеклянной пробкой и перемешать переворачиванием до растворения осадка;
4) отобрать пипеткой Мора аликвоту исследуемого раствора – 50 см3;
5) оттитровать раствором тиосульфата натрия до светло-желтой окраски;
6) добавить 1 см3 р-ра крахмала;
7) оттитровать до обесцвечивания раствора;
8) Расчет:
а) Массовую концентрацию растворённого в анализируемой пробе воды кислорода (Сх, мг/дм3) найти по формуле:
Cx =  (1), где
(1), где
С – концентрация раствора тиосульфата натрия, моль/дм3-эквивалента;
n – объём раствора тиосульфата натрия, пошедший на титрование, см3;
V – точная вместимость кислородной склянки, см3;
а – суммарный объём растворов хлорида марганца и иодида калия, добавленных в склянку при фиксации растворённого кислорода, см3 (при V ≤150 см3 а=2, при V ³150 см3 а=4);
б) Процент насыщения (Н) пробы кислородом рассчитать по формуле:
Н = Сх · 100 / С0 (1), где
Сх – концентрация кислорода, найденная экспериментально, мг/дм3;
С0 – нормальная концентрация при данной температуре и нормальном атмосферном давлении (находят из табл.).
В) Дефицит кислорода (D) в % найти по формуле: D = 100 – Н.
Таблица
Зависимость концентрации кислорода (С0) в воде от температуры (Атм. давление 760 мм рт. ст., парциальное давление кислорода р=0,209 атм.)
| Темпера- | Растворенный кислород, мг/дм3 | |||||||||
| тура, °С | 0,0 | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 |
| 14,65 | 14,61 | 14,57 | 14,53 | 14,49 | 14,45 | 14,41 | 14,37 | 14,33 | 14,29 | |
| 13,86 | 13,82 | 13,79 | 13,75 | 13,71 | 13,68 | 13,64 | 13,60 | 13,56 | 13,53 | |
| 12,79 | 12,76 | 12,72 | 12,69 | 12,66 | 12,62 | 12,59 | 12,56 | 12,53 | 12,49 | |
| 11,27 | 11,24 | 11,22 | 11,19 | 11,16 | 11,14 | 11,11 | 11,08 | 11,06 | 11,03 | |
| 10,03 | 10,01 | 9,99 | 9,97 | 9,95 | 9,92 | 9,90 | 9,88 | 9,86 | 9,84 | |
| 9,02 | 9,00 | 8,98 | 8,97 | 8,95 | 8,93 | 8,91 | 8,90 | 8,88 | 8,86 | |
| 8,18 | 8,16 | 8,14 | 8,13 | 8,11 | 8,10 | 8,08 | 8,07 | 8,06 | 8,04 | |
| 7,72 | 7,71 | 7,69 | 7,68 | 7,66 | 7,65 | 7,64 | 7,62 | 7,61 | 7,59 | |
| 7,44 | 7,42 | 7,41 | 7,40 | 7,38 | 7,37 | 7,35 | 7,34 | 7,32 | 7,31 |
|
|
|
ПДКв. О2 = 4,0 мг/дм3 в любой период года, ПДКв.р. О2 = 4,0 мг/дм3 в зимний период и 6,0 мг/дм3 – в летний период.
Вывод. Сравнить полученное содержание растворенного кислорода в воде с ПДКв., ПДКвр.
2. Определение БПК5
МУ РД 52.24-420-95.
При хранении в склянке с притертой пробкой в темноте содержание в ней растворенного кислорода убывает за счет жизнедеятельности микроорганизмов. БПК5 – убыль растворенного кислорода в аэробных условиях за пять суток, мг О2/дм3.
Диапазон определения – 1,0-11,0 мг О2/дм3.
Предварительные указания: необходимо обеспечить хорошие условия для аэробных биохимических процессов:
– исходная концентрация кислорода должна быть близка к равновесной концентрации с воздухом – 9 мг/дм3.
– минимальное потребление кислорода – не менее 2 мг/дм3, а оставшаяся концентрация не менее 3 мг/дм3 (через пять суток).
ПДКвр. БПК5≤2 мг/дм3.
Ход работы
а) Анализируемую пробу проаэрировать в течение 15 мин. для достижения равновесной концентрации с воздухом (энергичным встряхиванием в течение 10 мин. или с помощью компрессора).
б) Зафиксировать растворенный кислород, предварительно проведя калибровку кислородных склянок (указано выше).
в) Рассчитать исходную концентрацию растворенного кислорода (Сх1) по формуле (1).
г) Склянку на БПК5, плотно закрытую, инкубировать в темном месте в термостате при температуре 25°С с водным затвором в течении пяти суток.
д) Спустя пять суток, инкубируемую склянку достать из темного места, зафиксировать и определить растворенный кислород.
д) Рассчитать оставшуюся концентрацию растворенного кислорода (Сх2) по формуле (1).
е) Величину БПК5 найти по формуле: БПК5=Сх1-Сх2;
Оформление результатов анализа
Результат измерения представить в виде: Сх ± D, мг О2/дм3 (Р=0,95), где D – характеристика погрешности измерения для данной величины БПК5 (табл. 2). При выполнении измерений в пробах с величиной БПК5 свыше 11,0 мг/дм3 после соответствующего разбавления погрешность измерения не превышает величины D · n, где D – погрешность измерения БПК5 в разбавленной пробе; n – степень разбавления.
Таблица 2.
Значение характеристик погрешностей и ее составляющих (Р=0,95)
Таблица 3.
Величины БПК5 в водоемах с различной степенью загрязненности
В зависимости от категории водоема величина БПК5 регламентируется следующим образом: не более 3 мг O2/дм3 для водоемов хозяйственно-питьевого водопользования и не более 6 мг O2/дм3 для водоемов хозяйственно-бытового и культурного водопользования. ПДКвр (для водных объектов рыбохозяйственного назначения) (БПК5) при 20оС не должна превышать 2 мг O2/дм3. Вывод. Дать оценку состояния водного объекта по классам загрязненности, сравнить полученную величину БПК5 с ПДК для разных категорий водных объектов 3. Определение удельной электропроводности (УЭП) |
МУ РД 52.24-495-95.
УЭП – численная характеристика способности воды проводить электрический ток. В физическом смысле это величина обратно пропорциональная электрическому сопротивлению воды при t=25°С, находящаяся между двумя электродами с поверхностью в 1 см2, расстояние между которыми 1 см, мкСм/см.
УЭП характеризует суммарную концентрацию неорганических электролитов в воде: Na+, К+, Са2+, SO42-, Cl-, НСО3-.
Измерения УЭП провести на кислородомере «Анион – 410 D» в соответствии с рекомендациями, приведенными в паспорте прибора.
Вывод. Дать оценку исследуемой пробы по величине УЭП.


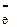 →Мn2++4Н2О
ПО (метод Кубеля) используется для анализа пресных вод, окисление которых не больше 100 мг О/дм3. Степень окисления – 40-50%.
Ход работы
1. Отобрать пипеткой Мора 50 см3 (или меньший объем) хорошо перемешанной нефильтрованной исследуемой пробы воды в мерную колбу на 250 см3;
2. Добавить 2,5 см3 серной кислоты (1:2);
3. Добавить 10 см3 0,01н перманганата калия (из I бюретки);
4. Колбу закрыть шариковым холодильником и поставить на плитку (чтобы закипело содержимое через 5 мин), кипятить 10 мин.;
5. Горячий раствор обесцветить, добавив 10 см3 0,01 н щавелевой кислоты (из II бюретки);
6. Обесцвеченную горячую смесь оттитровать раствором» 0,01н перманганата калия до появления розовой окраски (из I бюретки).
7. Параллельно с основным определением проводят холостое определение по той же методике, заменив анализируемую пробу 50 см3 дистиллированной воды.
8. Определение точной концентрации перманганата калия:
1. В оттитрованную пробу добавить 5 см3 0,01 н р-ра щавелевой кислоты (из II бюретки);
2. Оттитровать горячий раствор перманганатом калия до появления розовой окраски;
3. Точную концентрацию перманганата калия рассчитать по формуле:
Ск·Vk = Cп·Vп, где
С к – концентрация раствора щавелевой кислоты, моль/дм3-эквивалента;
С п – концентрация раствора перманганата калия, моль/дм3-эквивалента;
V к – объём раствора щавелевой кислоты, взятый для определения,
V п – объём раствора перманганата калия, пошедший на титрование, см3.
8. Расчет:
Рассчитать величину перманганатной окисляемости по формуле:
ПО, мг/дм3=
→Мn2++4Н2О
ПО (метод Кубеля) используется для анализа пресных вод, окисление которых не больше 100 мг О/дм3. Степень окисления – 40-50%.
Ход работы
1. Отобрать пипеткой Мора 50 см3 (или меньший объем) хорошо перемешанной нефильтрованной исследуемой пробы воды в мерную колбу на 250 см3;
2. Добавить 2,5 см3 серной кислоты (1:2);
3. Добавить 10 см3 0,01н перманганата калия (из I бюретки);
4. Колбу закрыть шариковым холодильником и поставить на плитку (чтобы закипело содержимое через 5 мин), кипятить 10 мин.;
5. Горячий раствор обесцветить, добавив 10 см3 0,01 н щавелевой кислоты (из II бюретки);
6. Обесцвеченную горячую смесь оттитровать раствором» 0,01н перманганата калия до появления розовой окраски (из I бюретки).
7. Параллельно с основным определением проводят холостое определение по той же методике, заменив анализируемую пробу 50 см3 дистиллированной воды.
8. Определение точной концентрации перманганата калия:
1. В оттитрованную пробу добавить 5 см3 0,01 н р-ра щавелевой кислоты (из II бюретки);
2. Оттитровать горячий раствор перманганатом калия до появления розовой окраски;
3. Точную концентрацию перманганата калия рассчитать по формуле:
Ск·Vk = Cп·Vп, где
С к – концентрация раствора щавелевой кислоты, моль/дм3-эквивалента;
С п – концентрация раствора перманганата калия, моль/дм3-эквивалента;
V к – объём раствора щавелевой кислоты, взятый для определения,
V п – объём раствора перманганата калия, пошедший на титрование, см3.
8. Расчет:
Рассчитать величину перманганатной окисляемости по формуле:
ПО, мг/дм3= 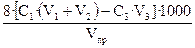 , где
С1 – точная концентрация перманганата калия, моль/дм3-эквивалента;
V1 – объем перманганата калия, добавленный в пробу до титрования (10 см3);
V2 – объем перманганата калия, пошедший на титрование, см3;
V3 – объем щавелевой кислоты (10 см3);
С3 – точная концентрация щавелевой кислоты, моль/дм3- эквивалента (0,01 н);
Vпр – объем пробы (50 см3).
Вывод: Дать оценку ПО проанализированной пробы воды в сравнении с ПДКв. (6 мг/дм3)
, где
С1 – точная концентрация перманганата калия, моль/дм3-эквивалента;
V1 – объем перманганата калия, добавленный в пробу до титрования (10 см3);
V2 – объем перманганата калия, пошедший на титрование, см3;
V3 – объем щавелевой кислоты (10 см3);
С3 – точная концентрация щавелевой кислоты, моль/дм3- эквивалента (0,01 н);
Vпр – объем пробы (50 см3).
Вывод: Дать оценку ПО проанализированной пробы воды в сравнении с ПДКв. (6 мг/дм3)
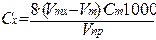 ,
,
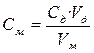 , где
, где