 |
Цель работы – научиться количественному определению массовой концентрации общего железа в пробах природных и очищенных сточных вод фотоколориметрическим методом с 2,2-дипиридилом.
|
|
|
|
Диапазон измерения массовой концентрации общего железа без разбавления пробы – 0,05-2,00 мг/дм3.
В этом интервале суммарная погрешность измерения с вероятностью Р=0,95 находится в пределах 0,01-0,03 мг/дм3.
Приборы, посуда, реактивы: КФК-3, мерные колбы на 50 см3, пипетки градуированные на 1, 2 см3, пипетки Мора на 25 см3, мерные колбы вместимостью 50 см3, р-ры: гидроксиламина солянокислого, ацетатного буферного раствора, 2,2-дипиридила.
Метод основан на взаимодействии ионов двухвалентного железа с 2,2-дипиридилом в области рН 3,5-8,5 с образованием окрашенного в красный цвет комплексного соединения трехвалентного железа. Интенсивность окраски пропорциональна массовой концентрации железа. Восстановление трехвалентного железа до двухвалентного проводится гидраксиламином. Окраска развивается быстро и устойчива в течение нескольких дней.
Ход работы
1. Исследуемую пробу воды тщательно перемешать
2. Отобрать 25 см3 (или меньший объем, содержащий не более 0,1 мг железа/дм3) в мерную колбу вместимостью 50 см3.
3. Прибавить 1 см3 10%-ного раствора гидроксиламина солянокислого, 2,00 см3 ацетатного буферного раствора, 1,00 см3 раствора 0,1%-ного раствора 2,2-дипиридила и довести до метки дистиллированной водой. После добавления каждого реактива содержимое колбы тщательно перемешать.
4. Раствор оставить на 15-20 минут для полного развития окраски.
5. Окрашенный раствор фотометрировать, применяя зеленый светофильтр (λ =540 нм) и кюветы с толщиной оптического слоя 1-5 см, по отношению к дистиллированной воде, в которую добавлены те же реактивы.
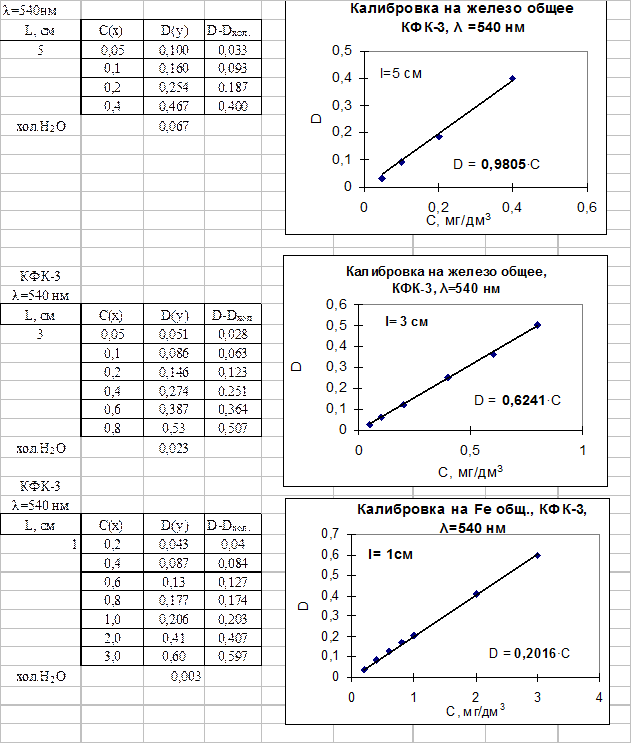
6. Массовую концентрацию железа С, мг/дм3, найти по градуировочному графику
7. Для построения градуировочного графика в мерные колбы вместимостью 50 см3 внести 0,0; 2,0; 10,0; 15,0; 20,0 см3 рабочего стандартного раствора железоаммонийных квасцов (0,005 Fe/см3). Добавить до объема 25 см3 дистиллированной водой. Далее провести анализ полученных растворов, как исследуемой пробы воды. Оптическую плотность измерить в тех же условиях, что и пробы. Построить градуировочный график, откладывая по оси абцисс массовую концентрацию железа, в мг/дм3, а по оси ординат – соответствующие значения оптической плотности.
|
|
|
8. Рассчитать коэффициент а методом наименьших квадратов по формуле:  , где
, где
n – количество измерений, х – концентрация железа, мг/дм3, D – оптическая плотность. Сравнить с найденным значением коэффициента а= D/С по калибровочной кривой (пакет анализа EXСEL – статистические расчеты)
Градуировочные графики на железо общее
Расчет
Массовую концентрацию железа (Х) в анализируемой пробе, мг/дм3, с учетом разбавления вычислить по формуле: 
 , где С – концентрация железа, найденная по градуировочному графику (или рассчитанная по формуле Х=D/a, где D = Dиссл.пр. – Dхол. –Dпр., где Dиссл.пр. – оптическая плотность исследуемой пробы, Dхол. – оптическая плотность холостой пробы – дистиллированная вода, Dпр.а – оптическая плотность пробы (фон), а – коэффициент, найденный из уравнения регрессии или методом наименьших квадратов), мг/дм3; V – объем воды, взятой для анализа, см3; 50 – объем, до которого разбавлена проба, см3.
, где С – концентрация железа, найденная по градуировочному графику (или рассчитанная по формуле Х=D/a, где D = Dиссл.пр. – Dхол. –Dпр., где Dиссл.пр. – оптическая плотность исследуемой пробы, Dхол. – оптическая плотность холостой пробы – дистиллированная вода, Dпр.а – оптическая плотность пробы (фон), а – коэффициент, найденный из уравнения регрессии или методом наименьших квадратов), мг/дм3; V – объем воды, взятой для анализа, см3; 50 – объем, до которого разбавлена проба, см3.
За окончательный результат анализа принимают среднее арифметическое результатов двух параллельных измерений, допустимое расхождение между которыми не должно превышать 25% при массовой концентрации железа на уровне предельно допустимой. Результат округляют до двух значащих цифр.
ПДКв железа составляет 0,3 мг Fe/дм3 (лимитирующий показатель вредности – органолептический), ПДКвр – 0,1 мг/дм3 (лимитирующий показатель вредности – токсикологический).
|
|
|
Вывод. Охарактеризовать пробу воды по содержанию в ней железа. Сравнить полученную величину с ПДК.
ПРАКТИЧЕСКАЯ РАБОТА №9
Определение содержания сульфатов в воде
Цель: Научиться определять содержания SО42- в поверхностных водах различными методами в зависимости от их содержания.
Приборы, посуда, реактивы: муфельная печь, электроплитка, водяная баня, мерный стакан на 0,5 дм3, НСl, часовое стекло, стеклянная палочка, фильтры «синяя лента», 96%-ым этиловый спирт, промывалка, тигель с крышкой, спиртовка, НNO3, р-р ВаСl2, р-р метилоранжа.
Часть 1. Весовой метод
Сущность метода: метод основан на очень малой растворимости сернокислого бария, выпадающего из раствора в кислой среде (количественно) в результате прибавления соли бария к воде содержащей ионы SО42-:
Ва+2+ SО4‾2=ВаSО4
Осадок отфильтровывается, прокаливается, и взвешиваются в виде ВаSО4. На чистоту осадка ВаSО4 и размер его частиц влияют условия осаждения: способ приливания ВаСl2, его избыток, взятое количество кислоты, отстаивание осадка и т.д. Поэтому важно проводить определение в строго установленных условиях.
Объем исследуемой воды для определения SО42- следует брать в зависимости от их содержания, которое должно быть приблизительно заранее известно
Выбор объема воды для анализа в зависимости от содержания SО42-
| Содержание SО42-, мг/дм3 | Менее 50 | 50-200 | 200-500 | Более 500 |
| V воды | Больше 500 | Менее 50 |
Если вода окрашена в темно-желтый цвет от большого количества растворимых в ней гумусовых веществ, то отмеренный для определения объема воды следует выпарить досуха, слегка смочить остаток НNO3 (концентрированный), прокалить его до удаления органических веществ, растворить в дистиллированной воде подкисленной НСl, отфильтровать в стакан для осаждения.
Ход работы
Воду для анализа выпарить (в случае малого содержания SО42-) или разбавить дистиллированной водой до 200 см3 в стакане на 0,5 дм3.
1. Пробу подкислить (после прибавления 1 капли метилоранжа) крепкой НСl до чистой реакции, довести почти до кипения.
2. Прилить по каплям 5 см3 раствора ВаС12 при непрерывном перемешивании стеклянной палочкой.
3. После осаждения SО42- стакан накрыть часовым стеклом оставить на 1-2 часа на водяной бане.
|
|
|
4. Осадок (количественно) отфильтровывать через фильтр «синяя лента», предварительно смочив для уплотнения 96%-ым этиловым спиртом. (Фильтрат должен быть прозрачным!).
5. При фильтровании на фильтр сливается сначала прозрачный раствор. Когда от раствора останется немного, под воронку подставляется другой стакан, после чего осадок (количественно) переносится на фильтр – удаляется со стенок стакана и палочки горячей водой из промывалки.
6. Осадок на фильтре промыть горячей водой, до отсутствия в промывных водах Сl‾ (проба с АgNО3).
7. Фильтр с влажным осадком перенести в предварительно прокаленный до постоянного веса тигель.
8. Тигель с неплотно закрытой крышкой и осадок высушить над слабым огнем горения.
9. Обуглить фильтр, усиливая нагревание, но бумага не должна воспламеняться (!), а тигель накаляться до красного цвета.
10. После окончания обугливания крышку тигля снять, тигель наклонить под углом 45º, накалить до красного цвета, дать углю выгореть.
11. Тигель прокалить пока осадок не сделается белым.
12. Тигель охладить в эксикаторе и взвесить.
13. Прокаливание повторить, если нет изменения в весе – закончить.
14. Вычисление результатов: вес ВаSО4 (в мг) – разница между окончательным весом тигля с осадком и весом пустого тигля.
Содержание SО42- определяется по формуле:
Сх=0,4115 · (1000/Vпр) · G, где
0,4115 – пересчет коэффициентов из ВаSО4 на SО42-
G – вес осадка ВаSО4, мг.
|
|
|


