 |
Общая характеристика аминов.
|
|
|
|
Амины – производные аммиака, в котором атомы водорода замещены на углеводородный радикал.
Амины бывают:
1) Первичные. СН3—NH2 (метиламин) – это амины из углеводородного радикала и группы NH2.

2) Вторичные – это производные аммиака, в котором два атома водорода замещены углеводородными радикалами

3) Третичные – производные аммиака, в котором все 3 атома водорода замещены углеводородными радикалами.

4) Четвертичные – амины, получающиеся из третичных путем присоединения радика-
ла к атому азота за счет донорно-акцепторной связи.

По природе углеводородных радикалов амины делятся на
1) алифатические
2) алициклические
3) ароматические
4) смешанные
Диамины – это органические соединения, содержащие две группы – NH2.
а) Н2N—CH2—CH2—NH2 б) H2N— (CN2)6—NH2
этилендиамин гексаметилендиамин – 1,6
Номенклатура аминов.
Амины называют с суффиксом – амин на конце.

Изомерия аминов.
Для аминов характерен следующий вид изомерии:
1) изомерия углеродного скелета
2) изомерия положения аминогруппы
Физические свойства.
Низшие амины (метиламин, диметиламин, триметиламин) при нормальных условиях – газы, имеющие запах аммиака. Средние члены ряда аминов – жидкости со слабым запахом, высшие – твердые вещества без запаха.
Способы получения.
1) Из галогеноалканов (аммонолиз галогеноалканов).
С2Н5OH, t С2Н5OH, t
CH3J + NH3 ————→ [ CH3NH3 ]J- + NH3————→CH3—NH2
иодметан метиламмоний – NH4J метиламин
йодид йодид
аммония
2) Реакция Зинина (получение аминов из нитросоединений):
+2 [ H+ ] +4 [ H+ ]
С6Н5NO2 —————→C6H5—N═O ————→ C6H5—NH2
нитробензол – H2O нитрозобензол – H2O анилин
Водород, используемый в данной реакции, получают при взаимодействии металлов с серной или хлороводородной кислотами.
|
|
|
№42.Физические свойства. Взаимное влияние атомов в аминах. Основность. Анилин. Сульфаниловая кислота. Применение сульфаниламидных препаратов
Физические свойства.
Низшие амины (метиламин, диметиламин, триметиламин) при нормальных условиях – газы, имеющие запах аммиака. Средние члены ряда аминов – жидкости со слабым запахом, высшие – твердые вещества без запаха.
Химические свойства.
I. Основные свойства аминов: R—CH2 ———— N — H основной центр
Н
нуклеофильный центр
Неподеленная пара электронов азота обуславливает основные свойства аминов. В ароматических аминах аминогруппа участвует в сопряжении с π-электронным облаком бензольного кольца. В связи с этим ароматические амины более слабые основания.
- Взаимодействие аминов с кислотами:
а) CH3—NH2 + HCl ——→ [ CH3NH3+ ]Cl-
метиламин метиламмоний –
хлорид
б) (СН3)2NH + HCl ——→ [ (CH3)2NH2+ ]Cl-
диметиламмоний
хлорид
в) (CH3)3N + HCl ——→ [ (CH3)3NH+]Cl-
триметиламмоний
хлорид
г) C6H5—NH2 + H2SO4 ——→ [ C6H5NH3+ ]HSO4
фениламин гидросульфат-
(анилин) фениламмония
I. Алкилирование аминов (реакция Гофмана)
t
H3C—NH2 + CH3J——→[ CH3—NH2—CH3+ ]J- + NaOH——→CH3—NH—CH3
(первичный амин) диметиламмоний – NaJ диметиламин
йодид – H2O (вторичный амин)
Соли аминов – кристаллические вещества, растворимые в воде, водные растворы их проводят электрический ток.
II. Ацилирование аминов (реакция Гофмана)
O O
// t, K ║
C6H5—NH2 + CH3—C—Cl ———→C6H5—NH—C—CH3
анилин хлорангидрид анилид уксусной к-ты
IV. Галогенирование (качественная реакция на анилин)

VI. Сульфирование:
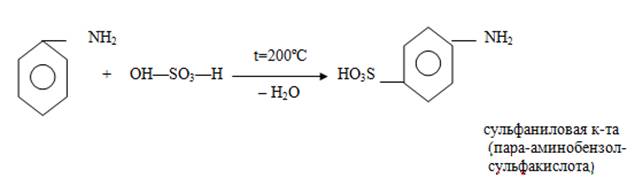


Анилин-является слабым основанием и реакции на лакмус не дает. в отличие от алифатических аминов. поэтому основность его доказывает. С6Н5-NH2+HCl={C6H5NH3}Cl; C6H5-NH2+H2SO4={C6H5NH3}SO4-H

Сульфанилова кислота Амид сульфаниловой к-ты Сульфаниламидные преп.-ты
|
|
|
Сама кислота не является лекарственным веществом, её амид (стрептоцид) является лекарственным препаратом и источником получения сульфаниламидных препаратов
№43.Азо- и диазосоединения. Реакции диазотирования первичных ароматических аминов.
1. Диазосоединениями называются вещества, содержащие в молекуле группировку из двух атомов азота, связанную с одним углеводородным радикалом. Общая формула  где X–анион кислоты или гидроксогруппа.
где X–анион кислоты или гидроксогруппа.
Наибольшее значение имеют диазосоединения ароматического ряда, из которых наибольшее значение имеют соли диазония 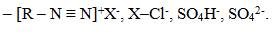
Названия солей строят по аналогии с солями аммония.

Азосоединениями называют вещества,содержащие в молекуле азогруппу -N=N-, связанную с двумя углеводородными радикалами. Простейшим представителем ряда ароматических азосоединений является азобензол. Другие представители называют как производные азобензола.
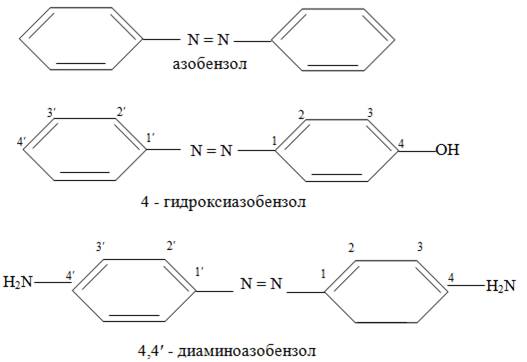 .
.
Получение солей диазония – реакцией диазотирования (действие HNO2 - в момент ее выделения на первичный ароматический амин).
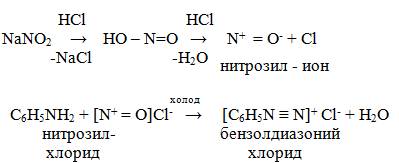
Реакции с солями диазония производят в растворе, сразу же после их получения, так как в сухом состоянии они легко разлагаются со взрывом при незначительном сотрясении. Соли диазония хорошо растворимы в воде и полярных органических растворителях
№44.Строение солей диазония. Их реакции азосочетания с фенолами. Реакции замещения диазокатиона на другие функциональные группы в солях диазония. Применение азокрасителей.
3.Химические свойства.
Соли диазония очень реакционноспособные вещества. Связь C-N в них сильно поляризована и склонна к гетеролитическому разрыву. При атаке нуклеофилом может происходить замещение диазогруппы на другую нуклеофильную группу. Эти реакции идут с выделением азота(N2).
А)Реакции, идущие с выделением азота:

|
|
|


