 |
Реакция фенольного гидроксила.
|
|
|
|
Кислотные свойства.
Большая подвижность атома водорода гидроксильной группы фенолов по сравнению со спиртами предопределяет и их большую кислотность. Доказательством большей кислотности фенолов по сравнению со спиртами является то, что фенол и его производные реагируют с водными растворами щелочей, образуя соли, называемые феноксидами. Феноксиды сравнительно устойчивы и в, отличие от алкоголятов, могут существовать в водных щелочных растворах. Однако при пропускании через такой раствор тока диоксида углерода феноксиды превращаются в свободные фенолы. Эта реакция доказывает, что фенол является более слабой кислотой, чем угольная кислота.
1. Фенолы могут взаимодействовать:
а) со щелочными металлами:

б) со щелочами:

Соли фенолов (феноляты) легко разлагаются минеральными кислотами, даже угольной: 
Реакции нуклеофильного замещения.
В связи с +М -эффектом гидроксильной группы фенолы являются более слабыми нуклеофилами, чем спирты.
Взаимодействие с галогенопроизводными. Учитывая слабые нуклеофильные свойства, в реакциях нуклеофильного замещения используют обычно не сами фенолы, а их соли – феноксиды щелочных металлов. При взаимодействии феноксидов с алкил и арилгалогенидами образуются простые эфиры фенолов.
1. Алкилирование (образование простых эфиров):
2. Ацили 
|
ование фенолов (образование сложных эфиров):
|
При действии на фенолы хлорангидридов или ангидридов карбоновых кислот образуются сложные эфиры. В отличие от спиртов фенолы не образуют сложных эфиров при действии на них карбоновых кислот. 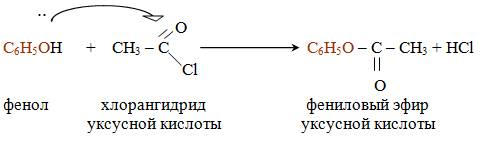
Взаимодействие с FeCl3 (качественная реакция на фенол) 
Реакции углеводородного радикала.
|
|
|
Ранее было отмечено, что гидроксильная группа в фенолах проявляет +М-эффект и ведёт себя как электронодонор по отношению к бензольному кольцу. Она является ориентантом I рода и направляет атаку электрофильных реагентов в орто -и пара - положения бензольного кольца. Благодаря электронодонорному влиянию гидроксильной группы фенолы вступают в реакции электрофильного замещения легче, чем бензол.
Реакции, идущие по бензольному кольцу.
Влияние атомов взаимно. Гидроксильная группа влияет на бензольное кольцо. Водородные атомы становятся подвижными в орто- и пара- положении и замещаются на другие атомы и радикалы:
а) галогенирование (реакция с бромной водой): 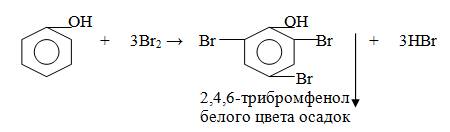 Эта реакция используется для качественного обнаружения и количественного определения фенолов.
Эта реакция используется для качественного обнаружения и количественного определения фенолов.
б) нитрование: 
в) сульфинирование: 
По правилам ИЮПАК сульфогруппа старше, чем гидроксильная группа, поэтому продукты сульфирования называются сульфокислотами.
Г) окисление фенолов.
Фенолы легко окисляются под действием кислорода воздуха:

№30.Фенол, резорцин, пирокатехин, гидрохинон, применение в медицине.
а)С6Н5 — ОН (фенол). -Бесцветное кристаллическое вещество с резким характерным запахом. При хранении окисляется кислородом воздуха, приобретая розовую окраску. Плавится при 42,3ºС, кипит при 182ºС, частично растворим в воде (6г в 100г воды). Обладает сильным антисептическим свойством, ядовит. При действии на кожу обжигает, образуя волдыри, язвы. 3% раствор фенола в воде называется карболовой кислотой и применяется как дезинфицирующее средство. Применяется для синтеза красителей, пластмасс, лекарственных препаратов.
б)Гидрохинон- содержится в толокнянке, легко окисляется, поэ тому используют в фотографии в качестве проявители.
в)Пирокатехин - кристаллическое вещество, темнеющее при хранении, используют как проявитель в фотографии, в синтезе красителей, пластмассе, лек-х преп.-ов.
|
|
|
г) Резорцин- кристаллическое вещество, темнеющее на воздухе, применяется как антисептик в производстве красителей, пластмасс.
№31.Оксосоединения. Электронное строение оксо-группы. Номенклатура альдегидов и кетонов. Способы получения альдегидов.
|
|
|


