 |
Кислотно-основные свойства
|
|
|
|
Спирты являются амфотерными соединениями, т.е. могут проявлять как свойства кислот, так и свойства оснований.
Кислотные свойства. Спирты как кислоты взаимодействуют с металлическим натрием с образованием алкоголятов (от лат. alcohol – спирт). В случае метанола их часто называют метилаты, этанола – этилаты, хотя по правилам номенклатуры ИЮПАК они имеют названия – метоксиды и этоксиды 
Cо щелочами одноатомные спирты взаимодействуют обратимо. При этом равновесие смещено в сторону спирта и щелочи. При удалении воды из системы равновесие можно сместить в сторону алкоголятов.
Основные свойства. Основным центром в молекуле спирта является гетероатом кислорода, обладающий неподелённой парой электронов. При действии на спирты сильными кислотами происходит присоединение протона к атому кислорода гидроксильной группы и образуется неустойчивый алкилоксониевый ион.
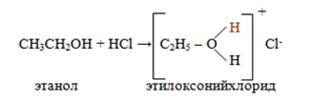
Реакции нуклеофильного замещения.
1. Взаимодействие с галогеноводородами:
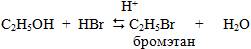
В присутствии щелочи равновесие смещается в сторону исходных веществ, в избытке кислот – в сторону конечных веществ.
2. Взаимодействие с производными фосфора:
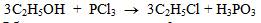
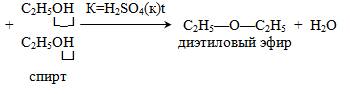
3. Образование простых эфиров:
4. Образование сложных эфиров (реакция этерификации): 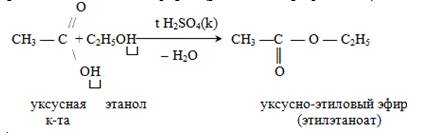
Реакция элиминирования.
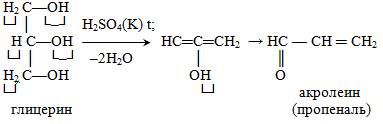
Выше была рассмотрена реакция межмолекулярной дегидратации спиртов, протекающая по механизму нуклеофильного замещения. Меняя условия проведения реакции (в частности, при использовании большего количества кислоты), можно провести конкурентную реакцию элиминирования, или внутримолекулярной дегидратации, при которой молекула спирта теряет молекулу воды и превращается в соответствующий алкен.
|
|
|
Окисление спиртов.
1. Окисление:
а) Первичный спирт окисляется до альдегидов 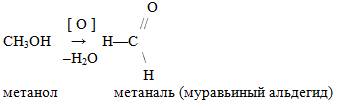
б) Вторичный спирт окисляется до кетонов: 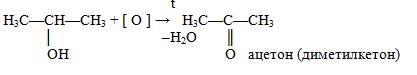
2. Горение:
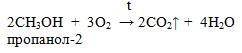
№ 27. Сравнительная характеристика одноатомных и многоатомных спиртов. Глицерин.
Одноатомные спирты содержат одну гидроксильную группу, а многоатомные две и более.
Химические свойства. Для двух- и трехатомных спиртов характерны основные реакции одноатомных спиртов. В
реакциях могут участвовать одна или две гидроксильные группы. Взаимное влияние гидроксильных групп проявляется в том, что многоатомные спирты — более сильные кислоты, чем одноатомные спирты. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют со щелочами, образуя соли. По аналогии с алкоголятями соли двухатомных спиртов называют гликолятами, а трехатомных — глицератами.
Качественной реакцией на многоатомные спирты, содержащие группы ОН при соседних атомах углерода, является ярко, синее окрашивание при действии свежеосажденного гидроксида меди (II). Цвет раствора обусловлен образованием комплексного гликолята меди.
Для многоатомных спиртов характерно образование сложных эфиров. В частности, при реакции глицерина с азотной кислотой в присутствии каталитических количеств серной кислоты образуется тринитрат глицерина, известный под названием нитроглицерин (последнее название неверно с химической точки зрения, поскольку в нитросоединениях группа -NO2 непосредственно связана с атом углерода)
Глицерин. Это простейший представитель трехатомных предельных спиртов – глицеринов. Это бесцветная, вязкая, гигроскопическая жидкость, сладкая на вкус. Смешивается с водой в любых соотношениях. Хорошо растворяет многие вещества. По заместительной номенклатуре глицерин называют пропантриол1,2.3
Химическиесвойства: 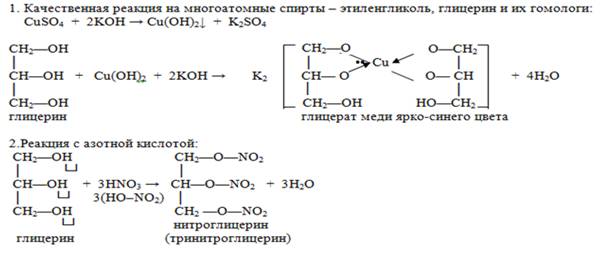
Применение
№ 28. Фенол. Классификация, номенклатура. Способы получения
Фенолы – органические соединения, в молекулах которых гидроксильные группы связаны с бензольным ядром.
|
|
|
Фенолы являются производными ароматических углеводородов.
В зависимости от числа гидроксильных групп фенолы делят на одно-, двух- и трехатомные фенолы.
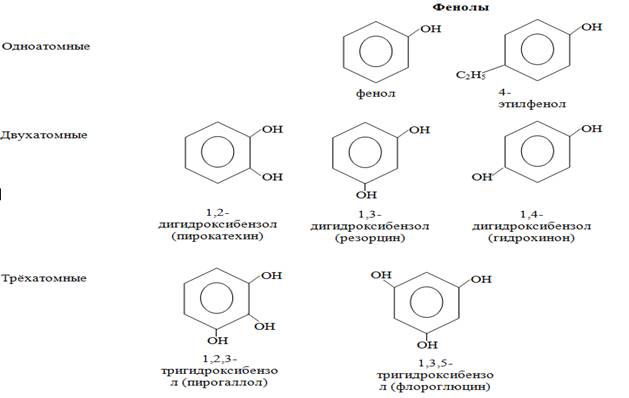
Номенклатура фенолов.
Название фенолам по правилам ИЮПАК дают с использованием тривиального названия «фенол». Нумерацию атомов углеродов бензольного кольца начинают от атома, непосредственно связанного с гидроксильной группой (если она является старшей) и продолжают в такой последовательности, чтобы имеющиеся заместители получили наименьшие номера.
Во многих случаях используют для производных фенолов и тривиальные названия.
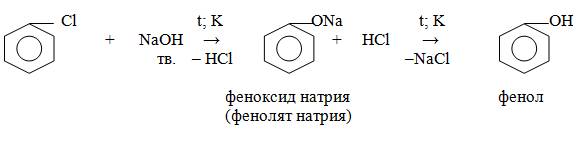
Получение: 1. Из каменноугольной смолы, образующейся при сухой перегонке угля.
2. Синтетическим путем из бензола и пропилена (кумольный способ).
3. Из хлорбензола:
№29.Химические свойства одноатомных фенолов в сопоставлении со спиртами. Кислотные свойства. Реакции нуклеофильного замещения (взаимодействие с галогенопроизводными). Качественные реакции на фенолы.
Химические свойства.
Химические свойства фенолов определяются наличием в молекуле как гидроксильной группы, так и
бензольного кольца, которые оказывают друг на друга взаимное влияние. Неподелённая пара электронов атома кислорода гидроксильной группы находится в р,π-сопряжении с π-электронами бензольного кольца. Поэтому в фенолах гидроксильная группа, помимо отрицательного индуктивного эффекта, обладает положительным мезомерным эффектом.
Величина +М - эффекта больше, чем –I-эффекта. Поэтому гидроксильная группа является электронодором по отношению к бензольному кольцу. Частичное смещение электронной плотности атома кислорода в сторону бензольного кольца приводит к повышению полярности связи О – Н и, следовательно, увеличению подвижности атома водорода гидроксильной группы.
|
|
|


