 |
История развития цитогенетики человека
|
|
|
|
Хромосомы человека впервые наблюдали Арнольд (1879) и Флемминг (1882). Винивортер в 1912 году исследовал гистологические срезы тестикул; он пришел к выводу, что у мужчин должно быть 47 хромосом, а у женщин – 48. Пэйнтер в 1921-1923 гг. анализировал тестикулы трех душевнобольных; вывод – в клетках человека 48 хромосом. Он впервые наблюдал половой бивалент в первом мейотическом делении.
В 1956 году, когда Tjio и Levan добавив воду к суспензии митотических клеток (фибробласты легкого эмбриона) человека перед их фиксацией на стекле, смогли отделить хромосомы друг от друга и сосчитать их количество. Независимо от их исследования, в том же году, число хромосом человека - 46, было установлено Ford.
В 1959 году Лежен показал, что причиной синдрома Дауна является трисомия хромосомы 21, а аномалии количества половых хромосом приводят к развитию синдрома Тернера (Форд) и синдрома Клайнфельтера (Джекобс, Стронг). В 1963 году был описан первый делеционный синдром – cri du chat - потеря участка короткого плеча хромосомы 5 у больных с выраженной задержкой умственного развития и плачем, похожим на крик кошки.
В 1961 году в Лондоне Пенроуз и Делханти впервые описали триплоидию у спонтанного абортуса. В 1967 году Якобсон и Бартер впервые на препаратах культуры клеток амниотической жидкости диагностировали у плода хромосомную аберрацию. Развитие пренатальной цитогенетики. В 1982 году впервые успешно провели анализ кариотипа плода в культуре лимфоцитов пуповинной крови после кордоцентеза.
Для анализа хромосом человека первоначально использовали рутинное окрашивание хромосом. Уксуснокислый кармин, орсеин, краситель Гимза. Эти красители в стандартных условиях окрашивают хромосомы равномерно по всей длине. Применяется для определения числовых аномалий кариотипа, для выявления структурных хромосомных аберраций.
|
|
|
В конце 60-х годов цитогенетические исследования получили новый толчок к развитию. Caspersson разработал протоколы дифференциального окрашивания, при которых получался набор из темных и светлых полос по всей длине каждой хромосомы. В 1971 году было принято соглашение о единой системе нумерации полос при дифференциальной окраске.
Для дифференциальной окраски Касперсон использовал флуоресцентное алкилирующее веществ о акрихин-иприт (Q -окрашивание). Данное вещество интеркалирует в двойную спираль ДНК и специфически связывается с атомом азота в положении 7 гуанина. Интеркалирование в спираль ДНК приводит к флуоресценции в видимой области спектра – в хромосомах появляются ярко флуоресцирующие участки - полосы или band.
Полосы, окрашивающиеся темным цветом при использовании одного метода, могут оставаться светлыми при использовании других методик. Способы получения полос делятся на две группы: (1)дающие полосы по длине целой хромосомы (G-, Q-, R-полосы); (2) окрашивающие специфические хромосомные структуры. Последним способом окрашивают конституциональный гетерохроматин (С-полосы), теломерные Т-полосы и районы ядрышкового организатора. "Полосатость" хромосом коррелирует с насыщенностью различными основаниями, плотностью упаковки хроматина.

В настоящее время основными методами дифференциальной окраски является G-, R-, C-методы. С-окрашивание – метод выявления прицентромерного гетерохроматина. Перед окрашиванием зафиксированных хромосом красителем Гимза их обрабатывают Ba(OH)2 или NaOH. При воздействии щелочи происходит денатурация ДНК. Из-за более плотной упаковки прицентромерный гетерохроматин менее подвержен действию щелочного раствора и способен к ренатурации. При окрашивании красителем Гимза окрашиваются только эти ренатурированные участки хромосомы.
|
|
|
G-окрашивание хромосом. В качестве предварительной обработки хромосом чаще всего используют инкубацию в солевом растворе или инкубацию с трипсином (или другой протеазой). Происходит денатурация и последующая ренатурация. Окрашивание G-сегментов. Предполагают, что данные сегменты богаты А-Т-парами, содержат мало генов (в основном гены тканевой дифференцировки клеток). Q и G-сегменты идентичны. Для материала G-сегментов характерна средняя или поздняя репликация, ранняя конденсация, обогащенность АТ-основаниями и LINE-повторами.
R-окрашивание хромосом. При этом окрашивании хромосомные препараты инкубируют при температуре +60°С в течение 3-5 минут в насыщенном растворе Ва(ОН)2. Затем их окрашивают раствором красителя Гимза. Рисунок хромосом при R-окрашивании противоположен G-исчерченности: R-положительные сегменты содержат большое количество пар G-C; содержат основное число генов, в том числе и гены домашнего хозяйства. Репликация ранняя, конденсация поздняя, обогащенность SINE-повторами.
Окрашивание Ag – специфическое выявление районов ядрышкового организатора, которые были активны в предыдущем клеточном цикле.
Революционным достижением цитогенетики был метод FISH - Fluorescence in situ hybridization. При этом радиоактивное мечение ДНК и РНК проб заменили на флюоресцентное. Флюоресцентные красители являются мягкими и простыми в употреблении, могут храниться неопределенно долго и позволяют одновременно исследовать несколько последовательностей ДНК.
Для картирования гена нерадиоактивная гибридизация in situ (молекулярная гибридизация на хромосомном препарате) была впервые применена в 1985 году. Метод FISH используют для идентификации точек разрыва, идентификации поврежденных генов, цитогенетического анализа ядра не делящихся клеток.
Флюоресцентная гибридизация in situ: FISH связана с использованием ДНК проб, меченных различными флюорофорами, специфичными для различных хромосом.
FISH сделала доступными для цитогенетического анализа ядра не делящихся клеток. Идентификация хромосом в них осуществляется простым подсчетом сигналов в каждом ядре. Изменение числа сигналов говорит о делеции или амплификации гена.
|
|
|
На современном этапе развития цитогенетики в практику вводятся методы 24-цветной флуоресцентной гибридизации in situ (FISH) и метод GTG-дифференциальной окраски хромосом (рис. 6.14). Данные методы значительно повысили разрешающую способность диагностики хромосомных патологий. Они сделали возможным проведение исследований при полном отсутствии митотических клеток. В целом, методы выявления хромосомных аномалий могут быть разделены на три основные группы: методы общего анализа кариотипа; методы селективного хромосомного анализа и методы общего анализа индивидуальных хромосом.
Метод FISH обеспечил прямую связь между микроскопом и секвенированием. Эта техника позволила увидеть хромосомную локализацию специфических последовательностей ДНК с помощью микроскопа. Прогрессивность методики заключалась в замене радиоактивного мечения ДНК и РНК проб, применяемого с 1969 года, на флюоресцентное. Флюоресцентные красители являются мягкими и простыми в употреблении, могут храниться неопределенно долго, дают высокое разрешение, и позволяют одновременно исследовать несколько последовательностей ДНК.
Техника FISH продолжает совершенствоваться, и сегодня локализация сегментов длиною 10 kb считается рутинной, а - 1 kb вполне достижимой. Одним из последних достижений FISH является использование проб, состоящих из пептидов и нуклеиновых кислот, которые позволяют по интенсивности сигнала определять количество комплементарных последовательностей. Хорошей иллюстрацией является изучение динамики теломер в клетках с использованием TTAGGG-специфических проб к концам хромосом. Использование COD-FISH позволяет определять инверсии и сестринские хроматидные обмены.
Появление FISH расширило возможности картирования генома, в частности идентификацию малых хромосомных аномалий. Метод FISH используют для упорядочивания ДНК клонов и идентификации точек разрыва, оценки построенных карт, идентификации поврежденных генов в больших коллекциях картированных сегментов генома человека - космидных, BAC, PAC и YAC. Например, FISH анализ клонов, содержащих перицентрическую инверсию хромосомы 16, обнаруживаемую у пациентов с острой миелогенной лейкемией, привел к идентификации двух генов (MYH11, тяжелой цепи 11 миозина гладких мышц, и CBFB, b-субъединицы ядерно-связывающегося фактора), которые, сливаясь, могут стать причиной лейкемической трансформации. FISH методика легла в основу открытия импринтинга генов региона 15q11-15q13 при синдромах Ангельмана и Прадера-Вилли.
|
|
|
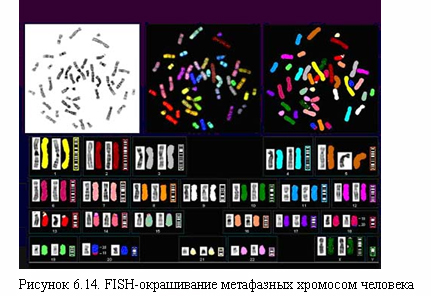
Широкое изучение генома с применением FISH метода выявило дуплицированные последовательности в удаленных участках генома, представляющие биологический интерес, с точки зрения причины хромосомных перестроек. Что еще более важно, FISH сделала доступными для цитогенетического анализа ядра не делящихся клеток. Идентификация хромосом осуществляется простым подсчетом сигналов в каждом ядре. Изменение числа сигналов свидетельствует о произошедшей делеции или амплификации гена. Так дупликация длиной 1Mb, которая является причиной синдрома Шарко-Мари-Тус, может быть определена интерфазной FISH. Позиционные сдвиги сигналов выявляют структурные перестройки, такие как транслокации и инверсии.

Интерфазная FISH делает возможным определение относительного количества специфических ДНК последовательностей, которые реплицируются в течение S фазы клеточного цикла. Подобные исследования показали, что большинство материнских и отцовских аллелей локусов реплицируются синхронно, в то время как, для аллелей импринтированных локусов характерна асинхронизация процесса - экспрессирующиеся аллели реплицируются раньше, чем молчащие аллели.
Методом FISH можно различать последовательности ДНК, находящиеся на расстоянии 50-100 kb друг от друга. Последним достижением цитогенетики является использование FISH на нитях ДНК, фиксированных на стекле. При этом маленький сигнал виден в интерфазу в световой микроскоп как флюоресцирующая линия. Эта модификация FISH используется для определения двойственности порядка генов в хромосомном регионе, для анализа организации тандемных дупликаций и определения малых перестроек в хромосомах.
Многоцветное окрашивание хромосом. Последним достижением цитогенетических технологий является анализ многоцветно окрашенных хромосом. Новая методика, получившая название спектрального кариотипирования (SKY) или мультиплексной FISH (M-FISH), появилась в результате трех новшеств. Во-первых, были созданы хромосом-специфические "краски": коллекции последовательностей, выделенных из каждой хромосомы. Во-вторых, за счет сочетания флюорохромов, для каждой хромосомы получена своя 24-х цветовая комбинация. В-третьих, для многоцветного анализа усовершенствована техника оптической микроскопии, системы фильтрации и отображения, позволяющая автоматически классифицировать каждый хромосомный сегмент. SKY и М-FISH обладают высокой эффективностью выявления транслокаций и других сложных аберраций, например, репликации регионов 11q, 21q и 22q при остром миелоидном лейкозе. Эти методы являются пригодными и для радиационной дозиметрии и для понимания пространственной организации хромосом в ядре. Метод М-FISH позволяет идентифицировать многие ранее не известные перестройки хромосом, особенно их концов.
|
|
|
Следующей трансформацией цитогенетики является реализация широкого сканирования генома на потерю или увеличение хромосомного материала без прямого осмотра хромосом. Техника, которая делает это возможным, называется сравнительная геномная гибридизация (CGH), разработана командой Ollie и Anna Kallioniemi, Dan Pinkel и Joe Grey (1992). При этой методике конкурирующие за связывание образцы геномной ДНК метятся красным и зеленым цветом. Соотношение красная-зеленая флюоресценция измеряется вдоль длины каждой хромосомы. Хромосомные регионы, которые эквивалентно гибридизуются с двумя образцами выглядят оранжевыми, а те, которые делетированы или амплифицированы - более красными или более зелеными. Техника CGH используется для изучения цитогенетики рака, например, CGH идентифицируют PIK3CA, каталитическую субъединицу фосфатидилинозитол3-киназы (PI3A), как онкоген рака яичников. ДНК-амплификационная техника также развивается для поиска генетических изменений в редких клетках, например, в "рогатых" клетках крови, являющихся предвестниками метастазирования опухоли.
Исследуемая ДНК – " тест-ДНК ", контрольная – " референс-ДНК " (например, исследуемая ДНК- ДНК из раковых клеток, контрольная ДНК – ДНК из здоровой ткани того же человека). Каждую из этих ДНК метят – тест – биотином, референс – дигоксигенином и смешивают в отношении 1:1. Далее проводят гибридизацию данной смеси с нормальными метафазными хромосомами любого здорового человека. После этого препарат обрабатывают авидином (он имеет высокое сродство к биотину и связан с зеленым флуорохромом) и антителами к дигоксигенину (дают красную флуоресценцию). Микроскопирование. В норме при отсутствии хромосомного дисбаланса красное = зеленому. Дупликация участка хромосомы или трисомия по хромосоме в тестируемой ткани: зеленое преобладает над красным. Делеция или моносомия приводит к преобладанию красного. Таким образом, оценивают интенсивность (отношение) зеленого и красного свечения. Если флуоресцентное отношение (ФО)=1 – норма; ФО больше 1 – увеличение повторов; ФО меньше 1 – потеря генетического материала.
Пример: Если в качестве исследуемой ДНК, меченной зеленым, взять ДНК мужчины, а в качестве контрольной – ДНК женщины (мечена красным), то после их гибридизации с метафазными хромосомами ФО на Х-хромосоме будет около 0,5. Если ДНК мужчины пометить красным, а ДНК женщины – зеленым, то ФО будет равен 2.
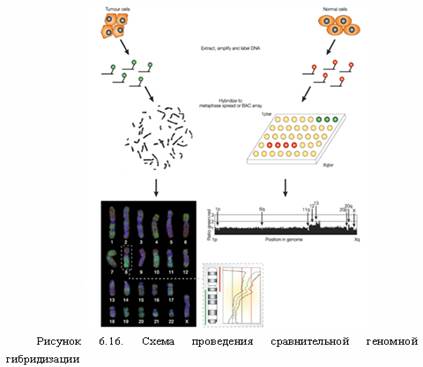
Преимущества данного метода: в одном эксперименте можно получить информацию об изменении количества ДНК по всему геному; не требует приготовления метафазных хромосом из исследуемой ткани; возможность анализа архивного материала (зафиксированных тканей). Недостатки: метод не чувствителен для выявления делеций, размеры которых менее 2 млн. п.н.; делеция должна быть представлена в 80% клеток и более. Чем она крупнее, тем в меньшем % клеток может быть представлена (но не менее 50%) и выявлена. Не выявляет инверсии и сбалансированные транслокации.
В настоящее время развиваются методы множественной-CGH. При этой технике, метафазные хромосомы как мишени для гибридизации замещаются на микрочипы – последовательности ДНК (размером около 150 кб) определенных хромосом. Каждая такая последовательность клонируется (ПЦР) и помещается в искусственные бактериальные хромосомы (ВАС). Весь геном может быть помещен в 3000 BAC. Таким образом, множественная-CGH эквивалентна одновременному проведению тысячи FISH. Множественная-CGH обеспечивает лучшее определение количества копий и более точную информацию о точках поломки в сегментах, которые потеряны или увеличены, чем простая CGH. Что еще более важно, каждый клон – это точка доступа к геномной последовательности, в которой могут быть идентифицированы пораженные гены. Несмотря на то, что CGH нечувствительна к изменениям, которые встречаются с низкой частотой в анализируемых клетках, ожидается, что множественная-CGH позволит многим группам оценить большее число опухолей на текущие изменения, используя общую платформу. Этот анализ может обнаружить прогностические маркеры, идентифицировать новые опухоль-супрессирующие гены или онкогены и, наконец, глубже понять механизмы развития рака. Кроме того, автор предполагает, что некоторые пренатальные диагностические тесты, которые в настоящее время используют FISH, также могут быть дополнены вариантами CGH. Есть надежда, что прогрессивные технологии, такие как множественная-CGH, сократят время и стоимость цитогенетического анализа, что сделает его доступным большему числу семей.
Новый метод в цитогенетике – сравнительный хромосомный пэйнтинг (Zoo - FISH). Районы гомологии хромосом разных видов выявляют с помощью гибридизации фрагментов ДНК отдельных хромосом одного вида на метафазных хромосомах других видов. Гомологичные районы выявляются в виде окрашенных участков – пэйнтов. Данный метод используют при анализе эволюции кариотипов. Примеры: пэйнтинговая проба хромосомы 2 человека при флуоресцентной гибридизации с хромосомами других видов приматов давала окрашенные участки на двух разных парах аутосом. Следовательно, в предковом кариотипе генетический материал второй хромосомы человека находился в двух разных хромосомах.
Другой пример: гомолог р плеча хромосомы 2 человека у гориллы и орангутанга имеет перицентрическую инверсию, которой нет у человека и шимпанзе. Этой инверсии нет и у узконосой обезьяны. Следовательно, инверсия возникла после отделения общего предка гориллы и орангутанга от ветки, ведущей к человеку и шимпанзе. Предковым состоянием является неинвертированная форма короткого плеча второй хромосомы.
Предполагаемый предковый кариотип приматов состоял из 25 пар хромосом и отличался от современного кариотипа человека 8 крупными перестройками, в частности в виде единых блоков были 3/21, 14/15, а короткие и длинные плечи нынешних хромосом 2, 16, 19 были разделены.
Проектные задания
Заполните таблицу "Механизм синтеза полипептидной цепи на рибосоме"
Заполните таблицу "Сравнительная характеристика ДНК и РНК"
· Заполните таблицу "Основные этапы развития цитогенетики"
|
Заполните таблицу
| Тип последовательности ДНК | Характеристика | % от геномной ДНК |
| Уникальные последовательности | ||
| Умеренно повторяющиеся последовательности | ||
| Микросателлитная ДНК | ||
| Минисателлитная ДНК | ||
| Сателлитная ДНК |
Заполните таблицу
| Тип хроматина | Характеристика | Локализация |
| Эухроматин | ||
| Факультативный гетерохроматин | ||
| Конститутивный гетерохроматин |
|
|
|


