 |
Химическим гальваническим элементом называют устройство из двух электродов, в котором химическая энергия превращается в электрическую.
|
|
|
|
Химическим гальваническим элементом называют устройство из двух электродов, в котором химическая энергия превращается в электрическую.
Рассмотрим систему, в которой не один, а два каких-нибудь металла, например цинк и медь, в виде пластинок опущены в растворы своих солей, разделенные диафрагмой. Каждый из металлов может выделить в раствор то количество ионов, которое отвечает равновесию его с раствором. Однако отвечающие такому равновесию потенциалы этих металлов неодинаковы. Цинк обладает более высокой способностью выделять ионы в раствор, чем медь, и поэтому приобретает более высокий отрицательный заряд.

Рис. 1. Схема гальванического
элемента.
Если пластинки соединить проволокой, то разница этих потенциалов пластинок и образование контактной разности потенциалов металлов Zn/Cu приводит к переходу соответствующего числа электронов с цинковой пластинки на медную. Это нарушает равновесие двойного слоя на обеих пластинках и с цинковой пластинки выделится вновь некоторое число ионов Zn2+ в раствор, а на медной пластинке разрядится соответствующее число ионов Сu2+. Таким образом, снова возникает разность в зарядах пластинок, вызывающая переход электронов с цинковой пластинки на медную, и дальнейшее течение описанных переходов ионов. В результате возникает самопроизвольно протекающий процесс, при котором цинковая пластинка будет растворяться, а на медной будут разряжаться ионы Сu2+ и выделяться металлическая медь. Переход электронов по проволоке от цинковой пластинки к медной дает электрический ток.
Гальванический элемент, основанный на описанном процессе, может служить источником получения электрического тока. Такой элемент был предложен в середине прошлого века Даниелем, Б. С. Якоби и др. Известно большое число других гальванических элементов подобного рода.
|
|
|
В основе всякой гальванической цепи лежит окислительно-восстановительная реакция, проводимая так, что на одном из электродов (отрицательном) происходит окисление (в элементе Якоби— растворение цинка), а на другом (положительном) —восстановление (в элементе Якоби — выделение меди).
Так, в основе работы элемента Якоби лежит реакция
Zn+Cu2+=Zn2++Cu или Zn+CuSO4=ZnSO4+Cu
Проводя указанную реакцию в гальваническом элементе, мы разделяем процессы окисления и восстановления, осуществляя их на различных электродах.
Zn0-2e-→ Zn2+ - окисление (происходит на отрицательном электроде);
Cu2++e-→ Cu0 – восстановление (происходит на положительном электроде).
В практике применяют иногда концентрационные гальванические элементы, которые состоят из двух одинаковых электродов (например, серебряных), опущенных в растворы одного и того же электролита (например, АgNО3), но разных концентраций. Источником электрического тока в таком элементе служит работа переноса электролита из более концентрированного в более разбавленный раствор.
Поскольку металл электродов одинаков (Ag), то растворимость обоих электродов будет одна и та же. Однако различие в концентрациях растворов приводит к тому, что равновесие Ag↔ Ag+ + e- у поверхности двух электродов будет неодинаковым. В более концентрированном растворе оно несколько сдвинуто влево по сравнению с равновесием в менее концентрированном растворе. Поэтому на электроде в менее концентрированном растворе избыток электронов окажется большим и этот электрод будет более отрицательным, а второй—менее электроотрицательным.
При замыкании электродов возникает ток. В результате работы элемента концентрации растворов постепенно выравниваются. В менее концентрированном растворе содержание AgNO3 увеличивается вследствие перехода ионов серебра с пластинки в раствор и поступления ионов NO-3 из более концентрированного раствора через пористую перегородку. В более концентрированном растворе количество ионов серебра уменьшается, благодаря осаждению их на поверхности пластинки; одновременно с этим освободившиеся ионы NO-3 перемещаются в менее концентрированный раствор. Следовательно, концентрация AgNO3 в растворе уменьшается. На электродах, находящихся в растворах AgNO3 меньшей и большей концентрации, протекают реакции
|
|
|
Ag0-e-↔ Ag+ Ag++e-↔ Ag0
Термодинамика гальванического элемента.
В гальванических элементах (рис. 1) химические реакции на электродах протекают тем медленнее, чем большим сопротивлением обладает внешняя цепь. Принципиально можно замкнуть электроды проводником бесконечно большого сопротивления, и реакция будет идти бесконечно медленно, так что в каждый момент будет существовать равновесие между электродами и растворами. Такое течение реакции является обратимым. В случае термодинамически обратимого процесса получается максимальная электрическая работа. Она равна ЭДС элемента (Е), умноженной на переносимый заряд. Если по время реакции произойдет восстановление и окисление z моль однозарядных ионов, то, по закону М. Фарадея, перенесенный заряд равен zF, где F— число Фарадея. Электрическая работа при изобарно-изотермическом процессе совершается за счет убыли энергии Гиббса, поэтому -∆ G=zFE. Подставив это выражение в уравнение Гиббса — Гельмгольца, получаем –zFE=∆ Hr -T∆ Sr. Так как при p=const  и ∆ G = -zFE, получаем
и ∆ G = -zFE, получаем
∆ Sr =  (5)
(5)
Отсюда
 , (6)
, (6)
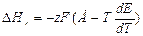 (7)
(7)
Производную  называют температурным коэффициентомЭДС. В зависимости от природы гальванического элемента он может быть положительным и отрицательным.
называют температурным коэффициентомЭДС. В зависимости от природы гальванического элемента он может быть положительным и отрицательным.
Уравнение (7) позволяет вычислить тепловойэффект реакции, протекающей вгальваническом элементе, путем измерения ЭДС и температурного коэффициента. Для определения константы равновесия этой реакции используют уравнение
 , (8)
, (8)
где
 , (9)
, (9)
а E0 - стандартная ЭДС при средних активностях всех ионов в растворе, равных единице. Из выражения (8) следует, что
|
|
|
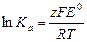 , а
, а 
Если активности ионов, участвующих в электрохимической реакции, не равны единице, то для оценки убыли энергии Гиббса вместо уравнения (8) применяют уравнение изотермы
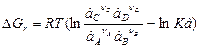
Например, для реакции

с учетом (7) и (8)
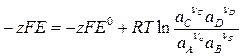
Отсюда следует общее выражение для ЭДС гальванического элемента
|
|
|

где Е° — стандартная ЭДС цепи.
Протекающую в элементе химическую реакцию можно разбить на две сопряженные реакции, проходящие в отдельных полуэлементах:  и
и 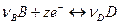 . Соответственно и выражения для потенциалов отдельных электродов (φ 1 и φ 2) могут быть получены с помощью уравнения изотермы:
. Соответственно и выражения для потенциалов отдельных электродов (φ 1 и φ 2) могут быть получены с помощью уравнения изотермы:


где φ 1 и φ 2 — стандартные потенциалы электродов.
На металлических электродах обычно протекают реакции типа Mz+ + ze-↔ M.
В соответствии с этой реакцией, а также с учетом того, что активность твердого вещества (металла) при данной температуре постоянна и равна единице, получают выражение для потенциала электрода, обратимого относительно катиона металла:
 (10)
(10)
Если в токоопределяющем процессе участвуют анионы, то, согласно реакции A + ze-↔ Az-, получают выражение для потенциала отдельного электрода, обратимого относительно аниона:
 (11)
(11)
(Активность окисленной формы аниона принимают за единицу. )
Выражение для потенциала электрода в общей форме

было выведено Нернстом. Это уравнение показывает, что потенциал электрода φ зависит от его природы (природа характеризуется величиной стандартного потенциала φ 0), температуры и активности ионов в данном растворе.
Стандартный потенциал φ 0 зависит от природы электрода и характеризует его электрохимическую активность. Для данного растворителя и заданной температуры величина стандартного потенциала постоянна. Абсолютное значение φ 0 определить невозможно, так как с помощью вольтметра измеряют только разность потенциалов двух электродов. Поэтому для измерения φ 0 составляют элемент из стандартного водородного электрода (СВЭ), потенциал которого условно принимают за нуль при любой температуре, и стандартного исследуемого электрода. СВЭ изображен на рис. 2. Он состоит из платиновой пластинки, опущенной в раствор кислоты с активностью ионов водорода, равной единице. Платиновая пластинка находится под током газообразного водорода, подаваемого под давлением 1, 013-105 Па (1 атм) при постоянной температуре.
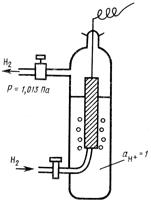
Рис. 2. Стандартный водородный электрод.
Физический смысл стандартного потенциала можно установить с помощью уравнения

где 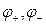 - электродные потенциалы,
- электродные потенциалы, 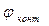 - контактный потенциал,
- контактный потенциал,  - жидкостной (диффузионный) потенциал.
- жидкостной (диффузионный) потенциал.
Если в этом уравнении  , то ЭДС элемента равна стандартному потенциалу электрода:
, то ЭДС элемента равна стандартному потенциалу электрода:

Это значит, что стандартный потенциал электрода содержит контактный и неучтенный диффузионный потенциал, т. е. содержит неизмеримые величины и поэтому не является абсолютным. Однако он точно определяет при стандартных условиях стандартную энергию Гиббса той окислительно-восстановительной реакции, которая протекает на электроде. Таким образом, за стандартный потенциал (относительно СВЭ) принимают потенциал электрода с активностью ионов, равной единице, при стандартных условиях. Так как φ конт входит в стандартный потенциал электрода, а φ дифф сводят к минимуму с помощью солевого мостика, то выражение для ЭДС элемента принимает вид
|
|
|

Измерив при р=1, 013•105 Па и Т=298 К ЭДС элемента из СВЭ и стандартного исследуемого электрода, получают φ 0 исследуемого электрода в водородной шкале.
Расположенные в определенном порядке стандартные потенциалы образуют ряд напряжений (водородную шкалу).
Если из полуэлементов, в которые входят два разных металла, составить гальванический элемент, то выше расположенный в ряду напряжений металл по сравнению с ниже расположенным будет иметь отрицательный потенциал. При вычитании из более положительного потенциала более отрицательного независимо от знаков потенциалов всегда получается положительная ЭДС.
Зная стандартные электродные потенциалы, можно вычислить потенциалы полуэлементов при любых активностях потенциалопределяющих ионов.
Обратимо работающие элементы — это такие элементы, в которых после размыкания цепи на каждом электроде устанавливается равновесие. В обратимом элементе реакцию можно прекратить, подсоединив к нему внешний источник тока с таким же значением ЭДС, но противоположного направления. Если увеличить ЭДС внешнего источника тока на малую величину, то реакция пойдет в обратном направлении. Если при прохождении электрического тока в разных направлениях на поверхности электрода протекает одна и та же реакция, но в противоположных направлениях, то такие электроды называются обратимыми. Примером обратимого элемента является рассмотренный ранее элемент Якоби — Даниэля, в котором при изменении направления тока реакция Zn+Cu2+=Zn2++Cu меняет направление. Электрод Cu|CuSO4 является обратимым, так как при
перемене направления тока протекают реакции Cu2++2e-→ Cu0 и Cu0-2e-→ Cu2+.
Если после размыкания цепи процесс на электродах продолжается, а при изменении направления электрического тока протекают другие реакции, не обратные друг другу, то элемент является необратимым. Примером необратимой цепи является элемент Вольта
-Zn|H2SO4|Cu(+)
В котором при работе на аноде происходит процесс окисления цинка
Zn ––– Zn+2 + 2e
а на катоде – процесс восстановления ионов водорода
2Н+ + 2 e ––– Н2
Если приложить к такому элементу противоположно направленную ЭДС, хотя бы на бесконечно малую величину, превышающую ЭДС самого элемента, на электродах будут происходить совершенно другие процессы. Так на отрицательном электроде, который теперь при электролизе будет называться катодом, пойдет реакция восстановления Н+.
2Н+ + 2 e ––– Н2, а на положительном (аноде при электролизе будет растворяться (и окисляться)) медь
Cu ––– Cu+2 + 2e
По свойствам веществ, участвующих в потенциалопределяющих процессах, а также по устройству все обратимые электроды делят на следующие группы: электроды первого и второго рода, окислительно-восстановительные и ионообменные электроды.
|
|
|


