 |
Скорость электрохимических процессов
|
|
|
|
Скорость электрохимических процессов
Скорость электрохимического процесса определяется количеством вещества, изменившимся за единицу времени t:
V = 
Так как между массой прореагировавшего вещества и количеством прошедшего электричества существует прямая пропорциональность, то, используя равенство (13), можно написать
V = kЭ 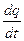 = kЭ I
= kЭ I
т. е. скорость электрохимической реакции пропорциональна силе тока I.
Все электрохимические реакции протекают на границе раздела электрод — электролит, а поэтому их скорость зависит от величины поверхности раздела Ω. Отношение силы тока к поверхности раздела называют плотностью тока:
i = I /Ω (17)
Размерность плотности тока А/м2.
Понятие об электродной поляризации
Пусть рабочий электрод погружен в окислительно-восстановительную систему. Через некоторое время на электроде установится равновесный потенциал, определяемый уравнением (9). Если подать напряжение, то потенциал рабочего электрода изменится. Разность между потенциалом электрода под током (φ 1), т. е. при наложенном напряжении, и равновесным потенциалом (φ ) называют электродной поляризацией:
∆ φ = φ 1 – φ
Она является функцией тока: чем выше плотность тока, тем больше значение поляризации. Если потенциал становится более отрицательным, поляризацию называют катодной, а если более положительным — анодной. Возникновение поляризации обусловлено замедлением электродного процесса. Любой электродный процесс представляет собой сложную гетерогенную реакцию, состоящую из ряда последовательных стадий. Скорость многостадийной реакции определяется скоростью наиболее медленной стадии. Это представление справедливо и для электрохимической реакции. Возникновение электродной поляризации связано непосредственно с той стадией, которая определяет скорость всего процесса. Если изменить ход процесса, т. е. увеличить его скорость, то и налагаемое напряжение может уменьшиться и стать меньше обратимого потенциала. Уменьшение электродного потенциала, по сравнению с обратимым, и процесс, обусловливающий его, называют деполяризацией . Значение поляризационных и деполяризационных явлений при практическом использовании неравновесных электрохимических систем велико. Потенциалы поляризованных электродов определяют напряжение электрохимической цепи, следовательно, и напряжение на клеммах химического источника тока, т. е. определяют энергетические затраты. Поэтому особенно важен выбор оптимальных условий проведения электрохимического процесса.
|
|
|
Концентрационная и химическая поляризация
Природа и число стадий электрохимической реакции зависят от ее характера, однако в ней можно выделить стадии, наблюдающиеся при протекании любого электродного процесса. Общими стадиями являются:
1) доставка исходных веществ к поверхности электрода;
2) удаление от поверхности электрода продуктов реакции;
3) протекание электрохимической реакции непосредственно у поверхности электрода.
Доставка исходных веществ к поверхности электрода и отвод продуктов реакции могут осуществляться тремя путями: миграцией, молекулярной диффузией и конвекцией. Миграция представляет собой передвижение ионов под действием градиента электрического поля, возникающего в электролите при прохождении тока. Молекулярная диффузия представляет собой перемещение частиц под действием градиента концентрации, возникающего в растворе при его качественной или количественной неоднородности. Конвекция представляет собой перенесение частиц растворенного вещества вместе с потоком движущейся жидкости, например при перемешивании. Отклонение потенциала под током от равновесного значения, вызванное замедленностью доставки и отвода участников реакции, называют концентрационной поляризацией. Концентрационная поляризация имеет важное значение для окислительно-восстановительных процессов и меньшее значение — для разряда простых металлических ионов. Концентрационная поляризация не единственная причина отклонения потенциала электрода под током от его равновесного значения. Обычно изменение потенциала при наложении тока оказывается больше, чем концентрационная поляризация. Это является следствием торможения на стадии присоединения или отдачи электронов. Поляризация, вызванная замедленностью разряда или ионизации при протекании электрохимической реакции, называется химической поляризацией. Химическую поляризацию называют также перенапряжением.
|
|
|
|
|
|


