 |
3. Окислительно-восстановительные электроды (редокс-электроды). Хингидронный электрод.
|
|
|
|
3. Окислительно-восстановительные электроды (редокс-электроды). Хингидронный электрод.
Поскольку все потенциалопределяющие процессы протекают с участием электронов, каждый электрод может быть назван окислительно-восстановительным. Однако окислительно-восстановительными условились называть такие электроды, металл которых не принимает участия в окислительно-восстановительной реакции, а является только переносчиком электронов, процесс же окисления — восстановления протекает между ионами, находящимися в растворе. Схему электрода и уравнение потенциалопределяющего процесса записывают в виде
(Pt) | Ox, Red; Ox + ze-↔ Red
где Ох и Red — условные обозначения окисленной и восстановленной форм вещества. Отсюда появилось название редокс-электроды. Наиболее широко применяемым редокс - электродом является хингидронный электрод.
Хингидронный электрод Рt | С6Н4О2, С6Н4(ОН)2, Н+ или (Рt) | X, Н2Х, Н+ состоит из платиновой пластинки (или проволоки), погруженной в насыщенный раствор хингидрона. Последний представляет собой комплексное соединение, образованное из хинона С6Н4О2 (X) и его восстановленной формы С6Н4(ОН)2(Н2Х) гидрохинона. При диссоциации хингидрона Н2Х•Х ↔ Н2Х + Х образуется эквимолекулярная смесь хинона и гидрохинона. Хингидрон трудно растворим в воде и в кислых растворах, поэтому легко получается насыщенный раствор. Достаточно добавить 0, 1 — 0, 2 г на 20 мл исследуемого раствора.
На хингидронном электроде протекает реакция
С6Н4О2 + 2Н+ + 2е- ↔ С6Н4(ОН)2,
которой соответствует выражение для потенциала
 (12)
(12)
Если принять, что коэффициенты активности хинона и гидрохинона равны, то активности хинона и гидрохинона будут одинаковы. В связи с этим уравнение (12) упрощается:
|
|
|

Стандартным потенциалом хингидронного электрода (  ) называют потенциал электрода с
) называют потенциал электрода с 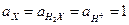 . Потенциал хингидронного электрода равен 0, 699 В при 25 °С.
. Потенциал хингидронного электрода равен 0, 699 В при 25 °С.
Хингидронный электрод очень удобен в применении благодаря простоте устройства и устойчивости потенциала, однако он имеет недостаток: его нельзя применять для исследования щелочных растворов и в присутствии посторонних окислителей и восстановителей.
4. Ионообменные электроды. Стеклянный электрод.
К ионообменным относят такие электроды, которые состоят из двух фаз: ионита и раствора, а потенциал на границе раздела фаз возникает за счет ионообменного процесса, в результате которого поверхности ионита и раствора приобретают электрические заряды противоположного знака. Иониты обладают повышенной избирательной способностью по отношению к определенному виду ионов, находящихся в растворе, поэтому электроды называют также ионоселективными. Известны ионоселективные электроды, обратимые относительно ионов натрия, калия, кальция и др.
Стеклянный электрод (рис. 5) Аg | АgСl | НС1 (с = 0, 1моль/л) | стекло | Н + является важнейшим представителем группы ионообменных (ионоселективных) электродов. Он представляет собой тонкостенный шарик из специального сорта токопроводящего стекла, наполненный раствором НС1 концентрации 0, 1 моль/л. В раствор НС1 погружен вспомогательный хлорсеребряный электрод, который служит внешним выводом к одному из полюсов прибора для измерения потенциала. Стеклянный электрод помещают в исследуемый раствор с неизвестной концентрацией определяемых ионов, в который помещают также электрод сравнения (хлорсеребряный или каломельный). Электрод сравнения присоединяют к другому полюсу. Таким образом, гальванический элемент, в котором один из электродов стеклянный, включает два электрода сравнения (внутренний и внешний).
|
|
|
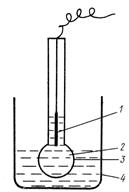
Рис. 5 Стеклянный электрод.
1 – внутренний электрод, 2 – внутренний раствор- 0, 1М раствор HCl 3 – стеклянная мембрана,
4 – сосуд с исследуемым раствором.
Потенциал стеклянного электрода:

Преимущества стеклянного электрода заключаются в том, что при измерении рН растворов не вводятся посторонние вещества (водород или хингидрон), потенциал не зависит от присутствия окислителей или восстановителей, равновесный потенциал устанавливается быстро, электрод не отравляется и пригоден для исследования мутных и окрашенных растворов.
По принципу применения электроды делят на индикаторные и электроды сравнения. Индикаторными называют электроды, потенциал которых однозначно меняется с изменением концентрации определяемых ионов (например, электроды Ag° |Аg+; Сu0 | Сu2+; Zn° | Zn2+; (Рt)Н2 | Н+; Рt | X, Н2Х, Н+ и др. ). Индикаторный электрод должен быть обратимым по отношению к определяемым ионам. Электродами сравнения называют такие электроды, потенциал которых известен, точно воспроизводим и не зависит от концентрации определяемых ионов, т. е. остается постоянным во время измерений. К электродам сравнения относят стандартный водородный электрод, хлорсеребряный и каломельный электроды. Применяемые на практике электроды сравнения должны быть легки в эксплуатации.
|
|
|


