 |
72. Законы Фарадея. Физический смысл постоянной Фарадея.
|
|
|
|
72. Законы Фарадея. Физический смысл постоянной Фарадея.
Постоя́ нная Фараде́ я (число Фарадея) — фундаментальная физическая постоянная, определяющая соотношение между электрохимическими и физическими свойствами вещества.
1. Масса вещества, выделяющегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит
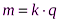 или
или  ,
,
Физический смысл: постоянная Фарадея (F) равна количеству электричества, которое необходимо пропустить через электролит для выделения на электроде 1 грамм-эквивалента вещества.
73. Применение электролиза.
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролитов.
Для осуществления электролиза к отрицательному полюсу внешнего источника постоянного тока присоединяют катод, а к положительному полюсу — анод, после чего погружают их в электролизер с раствором или расплавом электролита.
Электроды, как правило, бывают металлические, но применяются и неметаллические, например графитовые (проводящие ток).
На поверхности электрода, подключенного к отрицательному полюсу источника постоянного тока (катоде), ионы, молекулы или атомы присоединяют электроны, т. е. протекает реакция электрохимического восстановления. На положительном электроде (аноде) происходит отдача электронов, т. е. реакция окисления. Таким образом, сущность электролиза состоит в том, что на катоде происходит процесс восстановления, а на аноде — процесс окисления.
В результате электролиза на электродах (катоде и аноде) выделяются соответствующие продукты восстановления и окисления, которые в зависимости от условий могут вступать в реакции с растворителем, материалом электрода и т. п., — так называемые вторичные процессы.
|
|
|
Электрохимические процессы широко применяются в различных областях современной техники, в аналитической химии, биохимии и т. д. В химической промышленности электролизом получают хлор и фтор, щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, химически чистые водород и кислород и т. д. При этом одни вещества получают путем восстановления на катоде (альдегиды, парааминофенол и др. ), другие электроокислением на аноде (хлораты, перхлораты, перманганат калия и др. ).
Электролиз в гидрометаллургии является одной из стадий переработки металлсодержащего сырья, обеспечивающей получение товарных металлов.
Электролиз может осуществляться с растворимыми анодами - процесс электрорафинирования или с нерастворимыми - процесс электроэкстракции.
Главной задачей при электрорафинировании металлов является обеспечения необходимой чистоты катодного металла при приемлемых энергетических расходах.
В цветной металлургии электролиз используется для извлечения металлов из руд и их очистки. Электролизом расплавленных сред получают алюминий, магний, титан, цирконий, уран, бериллий и др.
Для рафинирования (очистки) металла электролизом из него отливают пластины и помещают их в качестве анодов в электролизер. При пропускании тока металл, подлежащий очистке, подвергается анодному растворению, т. е. переходит в раствор в виде катионов. Затем эти катионы металла разряжаются на катоде, благодаря чему образуется компактный осадок уже чистого металла. Примеси, находящиеся в аноде, либо остаются нерастворимыми, либо переходят в электролит и удаляются.
74. Коррозия металлов. Химическая и электрохимическая коррозия. Процессы, происходящие при электрохимической коррозии.
|
|
|
Разрушение металла под воздействием окружающей среды называют коррозией.
Коррозия помимо уничтожения металла отрицательно влияет на эксплуатационные характеристики деталей, содействуя всем видам разрушения.
Коррозия в зависимости от характера окружающей среды может быть химической и электрохимической.
Электрохимическая коррозия имеет место в водных растворах, а так же в обыкновенной атмосфере, где имеется влага. Электрохимическая коррозия представляет собой процесс разрушения металла в результате воздействия на него гальванических элементов, образование которых становится возможным в коррозионной среде. Электрохимическая коррозия металлов отличается от химической тем, что последняя протекает без электротока. А первопричина этих видов коррозии, коей является термодинамическая неустойчивость, остается неизменной. Металлы легко переходят в разные состояния (включая и более устойчивые), причем в этом случае отмечается снижение их термодинамического потенциала.
Сущность этой коррозии в том, что ионы металла на поверхности детали, имея малую связь с глубинными ионами, легко отрываются от металла молекулами воды.
Металл, потеряв часть положительно заряженных частиц, ионов, заряжается отрицательно за счет избыточного количества оставшихся электронов. Одновременно слой воды, прилегающий к металлу, за счет ионов металла приобретает положительный заряд. Разность зарядов на границе металл – вода обуславливает скачок потенциала, который в процессе коррозии изменяется, увеличиваясь от растворения металла, и уменьшаясь от осаждения ионов из раствора на металле.
Химическая коррозия может происходить за счет взаимодействия металла с газовой средой при отсутствии влаги. Продуктом коррозии являются оксиды металла. Образуется пленка на поверхности металла толщиной в 1…2 периода кристаллической решетки. Этот слой изолирует металл от кислорода и препятствует дальнейшему окислению, защищает от электрохимической коррозии в воде. При создании коррозионно-стойких сплавов – сплав должен иметь повышенное значение электрохимического потенциала и быть по возможности однофазным.
|
|
|


