 |
Физические и химические свойства карбоновых кислот
|
|
|
|
НООС; СН3СООН; С2Н5СООН – жидкости хорошо растворимые в воде, жидкие обладают запахом. С3Н7СООН - С8Н17СООН масляные жидкости плохо растворимые в воде. Начиная с каприновой кислоты С9Н19СООН – твердые вещества, нерастворимые в воде, но растворимые в спирте, в эфире, без запаха.
С увеличением молекулярной массы кислот повышается их температура кипения и уменьшается плотность (см. табл. на стр. 220 Л№5). Из таблицы видно, что кислоты имеют высокие температуры кипения и плавления. Это связано с тем, что их молекулы, подобно воде и спирту, находятся в ассоциированном состоянии виде димеров. Ассоциация молекул кислот обусловлена образованием водородных связей:
…О = С – ОН …О = С – ОН…О = С – ОН
| | |
RRR
Водородные связи в кислотах прочнее, чем в спиртах, так как связь О-Н в кислотах более поляризована. Общие химические свойства карбоновых кислот обусловлены строением карбоксильной группы – СООН.
Электронный характер строения карбоксильной группы.
Карбоксильная группа представляет собой сочетание двух групп карбонильной С = О и гидроксильной ОН. Они оказывают друг на друга сильное влияние. Свойства карбоксильной группы не являются простой суммой свойств карбонила и гидроксила. Карбоновые кислоты отличаются по свойствам как от альдегидов и кетонов, так и от спиртов. Гидроксильная группа кислот легче отщепляет протон, чем гидроксильная группа спиртов, так как влияет полярная карбонильная группа, происходит усиление кислотности.
| (II) |
| (I) |

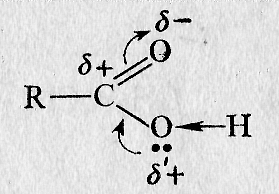
Карбонильный атом углерода, несущий положительный заряд, притягивает электронные пары не только связей R – C и С = О, но и свободные электронные пары кислорода гидроксильной группы. Поэтому гидроксильный кислород сильнее оттягивает электронную пару связи О – Н (I) усиливая положительный заряд на водороде (II). Для кислот наиболее типичны реакции, связанные с кислотными свойствами, реакции которых сопровождаются разрывом связи О– Н, а также реакции замещения гидроксильной группы. Для остальной части молекулы возможны реакции, обусловленные структурой радикала.
|
|
|
Подвижность – Н - карбоксильной группы. Диссоциация кислот. Образование солей.
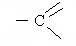
| R |
| OН |
| О |
| O |
R – C – O-+ H+
Водные растворы кислот изменяют окраску индикаторов и являются электролитами. Но кислоты они слабые, более сильная – муравьиная кислота. На силу кислот, т. е. на легкость отщепления протона, оказывает также влияние радикал, связанный с карбоксильной группой.
При взаимодействии с активными металлами, оксидами металлов, основаниями водород карбоксильной группы кислоты замещается на металл и образуются соли:
1) 2СН3СООН + Mg → (СН3СОО)2Mg + H2
2) 2СН3СООН + CaO → (СН3СОО)2Ca + H2O
3) СН3СООН + NaOH → СН3СООNa + H2O
Реакции замещения гидроксила в карбоксиле (образование функциональных производных карбоновых кислот).
А) образование галогенангидридов.
При замещении гидроксила карбоксильной группы кислоты галогеном образуются производные кислот – галогенангидриды:
| О |
| СН3 |
| ОН |
| О |
| СН3 |
| Cl |
3 + PCl3 → + H3PO3
| хлорангидрид уксусной кислоты (хлористый ацетил) |
Хлорангидриды реакционно-способные соединения, используются в различных синтезах.
Б) образование ангидридов.
| O |
| O |
| - СН3 |
| О |
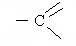
| НО |
| С |
| О |
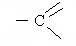
| СН3 |
| ОН |
| хлорангидрид уксусной кислоты (хлористый ацетил) |
|
|
|
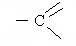
| R |
| O-R’ |
| О |
|
|
|


