 |
Межнейронные связи. Синапсы
|
|
|
|
Следует различать два вида межнейронных связей: 1) локальный – синаптический и 2) «диффузный, несинаптический», осуществляющийся посредством влияния на окружающие клетки циркулирующих в межклеточных пространствах нейроактивных веществ. Они оказывают модулирующее действие на электрогенез и многие жизненно важные процессы в нервных клетках.
Синапс (от греч. sinapsis – прерывать) – специализированный, изолированный глиальной оболочкой контакт между нейронами, где происходит передача возбуждения от одной клетки к другой. Нередко синапсом также называют свободный от глиальной оболочки транзиторный участок аксона (обычно варикозность), где происходит передача возбуждения на отростки или тело нейронов (касательный синапс) или на прилежащие эффекторные ненервные клетки – мышечные (нейро-мышечный синапс), эпителиальные (нейро-эпителиальный синапс) и т. д.
Понятие синапса было введено на основании физиологических наблюдений Шеррингтоном в 1897 г. Морфологически они выявились методами импрегнации солями серебра и золота по методу Гольджи-Дейнека, а также при окраске метиленовым синим по методу А.С. Догеля. Окончательное подтверждение их наличия было осуществлено только в середине нашего столетия с помощью электронного микроскопа. Тем самым была завершена многолетняя и плодотворная дискуссия между сторонниками «нейронной теории» строения нервной системы, согласно которой, нервная клетка считалась основной структурной и функциональной единицей, и сторонниками «ретикулявисткой теории», которые провозглашали постулат о непрерывном соединении отростков нейронов в единую «сеть или синцитий».
Синапсы, как выяснилось, обладают, с одной стороны, стабильной пространственной организацией, с другой - высокой пластичностью и считаются ключевым местом коммуникации между нейронами, нейронами и другими клетками. В головном мозге человека содержится приблизительно 1018 химических синапсов, а плотность расположения синапсов, например, в коре полушарий большого мозга может достигать 109/мм3.
|
|
|
Классификация синапсов. В нервной системе описано два вида синаптических контактов: 1) электрические синапсы и 2) химические синапсы. Первые типичны для межнейронных связей в нервной системе низших позвоночных и для нейроглиальных клеток, формирующих своеобразные сплетения из астроцитов и олигодендроцитов. Они также встречаются в нервной системе высших позвоночных и человека. Вторые распространены в нервной системе всех животных, хотя прослеживается четкая эволюционная тенденция к увеличению их предтавительства в нервной системе высших позвоночных и беспозвоночных животных.
Электрический синапс соответствует по своему строению щелевидному контакту (нексусу, gap junction). Он способен проводить возбуждение благодаря межклеточным порам, образованных белковым комплексом - коннексоном, состоящим из шести трансмембранных белков – коннексинов. Диаметр пор позволяет клеткам свободно обмениваться не только неорганическими ионами (что и определяет электрогенез этих контактов), но и достаточно крупными молекулами, в том числе белками и даже, возможно, низкомолекулярными РНК. Отсутствие канальных (поровых) ворот у коннексонов приводит к постоянно открытому состоянию межклеточных пор и двусторонней передачи возбуждения, направление передачи которого определяется только градиентом концентрации ионов. Ширина синаптической щели достигает 3-4 нм, что способствует быстрому проведению импульса (синаптическая задержка составляет всего 2-3 µсек).
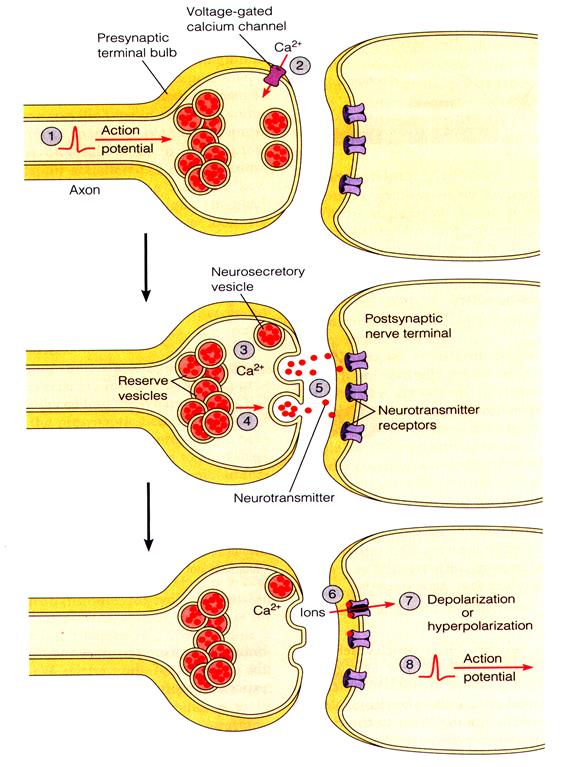
В химических синапсах (рис. 1, 2) передача электрического возбуждения опосредуется химическими веществами – нейромедиаторами, выделяемыми пресинаптическим окончанием и взаимедействующие с рецепторами на постсинаптической мембране. Наличие промежуточного химического звена в передаче возбуждения от одной клетки другой приводит к замедлению проведения электрического импульса в упомянутых синапсах – синаптической задержке, которая составляет примерно 10-20 µсек. Медиатор выделяется только в направлении от пре- к постсинапсу – т.е. химические синапсы односторонние. Имеются т.н. «реципрокные синапсы», у которых синаптические пузырьки раположены с двух сторон, но, и в этом случае, передача импульса происходит в конкретный период времени в одном направлении.
|
|
|


В головном мозге млекопитающих химические синапсы преобладают, более редко встречаются смешанные (химические и электрические) и электрические синапсы. Синапсы отличаются определенной пластичностью структурной организации и имеют разные функциональные характеристики, поэтому они классифицируются по нескольким признакам. (Рис. 1,2)
По расположению на нейроне синапсы разделяются на аксональные (аксодендритические, аксошипиковые, аксосоматические, аксоаксональные) и дендритические (дендродендритические, дендросоматические, дендроаксональные) типы. Крайне редко встречаются сома-соматические синапсы. Коллатерали аксонов многих нейронов, особенно в ЦНС, образуют аксо-аксональные окончания на аксонах собственных нервных клеток. Таким образом, можно сказать, что любая часть нейрона может образовывать синаптические контакты с любой частью другого нейрона.
По степени сложности морфологической организации, синапсы подразделяются на: простые и сложные (рис. 3). Простые синапсы имеют одну пре- и одну постсинаптическую активные зоны, образованы концевой веточкой аксона (синапсы типа «конец в конец») или его претерминальными отделами аксона (касательные синапсы «по ходу – et passant»). Сложные синаптические контакты образованы большим числом разнообразно взаимодействующих пре- и постсинаптических зон, объединенных в единый структурно-функциональный комплекс, как правило, окруженный астроцитарной капсулой. К сложным комплексным синаптическим образованиям относятся диады, триады, сериальные, реципрокные синапсы, гломерулы и гломерулоподобные синапсы (сочетанные множественные, независимые множественные, комплексные множественные синапсы), гребнеобразные синапсы, смешанные электро/химические синапсы.
|
|
|
По особенности геометрии активных зон (изогнутость, инвагинации, выросты и др.) синапсы можно разделить на контакты с инвагинацией/инвагинациями пресинаптической мембраны в постсинаптическую зону и без таковых. Степень инвагинации варьирует от незначительной до четковыраженной, вплоть до полного углубления одной зоны синапса в другую. Такие формы могут отражать структурные конформации синаптических контактов и высокодинамичные перестройки формы синапсов и самих нервных клеток в процессе их функционирования.
По степени выраженности пресинаптического и постсинаптического гранулярно-волокнистого парамембранного материала синапсы подразделяются на контакты с выраженным постсинаптическим уплотнением (ПУ) и широкой
синаптической щелью (ассиметричный, тип I по Е. Грею) и синапсы с менее выраженным ПУ и узкой синаптической щелью (симметричный, тип II по Е. Грею). Кроме того, различия пространственной организации ПУ позволяют подразделять синапсы на простые неперфорированные, простые перфорированные (подково-, гантеле- и кольцеобразные ПУ) и множественные перфорированные (две и более перфорации в ПУ). Аксошипиковые синапсы подразделяются на синапсы с шипиковым аппаратом (ША) и без него.
По высоте и форме плотных проекций (ПП) (рис. 2) пресинаптической решетки выделяются синапсы с высокими и низкими ПП, овальными, круглыми, треугольными и полигональными ПП. По размерам активной зоны синапсы можно разделить на мелкие (50-200 нм), средние (201-400 нм), крупные (401-600 нм) и очень крупные (> 600 нм).
По медиаторной специфичности, форме и размерам синаптических пузырьков (СП) синапсы подразделяются на: холинергические, катехоаминергические (адрен – и норадренергические, серотонинергические, допаминергические), аминокислотные (ГАМК, глутамат, глицин, таурини др.), пуринергические, (производные аденина:АТФ, аденозин, инозин), пептидергические ( энкефалины, эндорфины, вещество Р и др.), гистаминергические. Медиаторы находятся, в основном, в синаптических пузырьках (везикулярный компонент); часть медиатора раположена в цитоплазме терминали (цитоплазматический комплонент). Их соотношение может меняться в зависимости от типа синапса и его функционального состояния. Наиболее мелкие (50 нм) сферические электроннопрозрачные СП характерны для ацетилхолин- и глютаматергических синапсов. Несферические электронно-прозрачные СП – в большей степени для ГАМК- и глицинергических синапсов. Мелкие (50 нм) сферические электроннонепрозрачные (гранулярные) СП – для катехоламин- и серотонинергических синапсов. Для пептидергических синапсов характерны крупные (120-300 нм) электронно-непрозрачные (гранулярные) СП. В одном синапсе могут находиться синаптические пузырьки разной морфологии и содержащие разные медиаторы, а также СП, содержащие несколько медиаторов (правило Дейла).
|
|
|
Сигнальные вещества - нейромедиаторы (или нейромодуляторы) должны удовлетворять ряду критериев. Прежде всего, они должны продуцироваться нейронами и храниться в синапсах; при поступлении нервного импульса они должны выделяться в синаптическую щель, избирательно связываться со специфическим рецептором на постсинаптической мембране другого нейрона или мышечной клетки, стимулируя эти клетки к выполнению ими своих специфических функций.
По степени изоляции синапса отростками астроцитов от окружающего нейропиля выделяют неизолированные, частично и полностью изолированные синаптические контакты. Максимальная изоляция синапсов достигается путем образования мультиламеллярной астроцитарной оболочки. Взаимоотношения нейрон – астроцит являются весьма лабильными и степень глиальной изоляции синаптических контактов может значительно меняться в процессе жизнедеятельности. В настоящее время сложилась концепция о нейро-глиальной единице в составе нервной ткани (см. раздел Глия).
По характеру постсинаптического потенциала синапсы делятся на: возбуждающие и тормозные. Четкие структурные эквиваленты тормозных и возбуждающих синапсов отсутствуют. Химическая природа медиатора также не имеет определяющего значения (правило Экллза). Поэтому только иммуноцитохимическое определение наличия тормозных или возбуждающих постсинаптических рецепторов является доказательством функционального типа синапса. Большинство нейромедиаторов стимулируют открывание ионных каналов, и лишь только немногие — закрывание. Характер изменения мембранного потенциала постсинаптической клетки зависит от типа канала. Изменение мембранного потенциала от -60 до +30 мВ за счет открывания Nа+-каналов приводит к возникновению возбуждающего постсинаптического потенциала действия (возбуждающий синапс). Изменение мембранного потенциала с -60 мВ до -90 мВ за счет открывания Cl--каналов ингибирует потенциал действия (гиперполяризация), в результате чего возбуждение не передается (тормозной синапс).
|
|
|
Структурная организация химических синапсов различных типов во многом сходна. В синапсе по направлению распространения нервного импульса выделяют пресинаптическую зону, синаптическую щель и постсинаптическую зону, т.е. химические синапсы имеют ярко выраженную асимметричную организацию. (Рис. 4)
Основная функция пресинаптической зоны химического синапса – превращение электрической энергии нервного импульса в адекватный экзоцитоз синаптических пузырьков и выделение определенного количества нейромедиатора в синаптическую щель, необходимого для возбуждения постсинаптического потенциала и последующей передачи нервного импульса в цепи нейронов.
В пресинаптической зоне выделяют: 1) пресинаптическую мембрану, 2) цитоскелет терминали и его специализированные гексагонально расположенные парамембранные филаментозные образования – плотные проекции (ПП), составляющие основу пресинаптической решетки; 3) однородную или смешанную (гранулярные, агранулярные, крупные, мелкие) популяцию синаптических пузырьков (СП); 4) единичные или многочисленные митохондрии; 5) микротрубочки и актиновые микрофиламенты; 6) элементы агранулярной эндоплазматической сети (АЭС); 7) микропиноцитозные пузырьки, эндосомы и инвагинации, осуществляющие транспортные функции (рис. 1, 2, 4).
Цитоскелет терминали состоит из актиновых филаментов диаметром 6-12 нм и длиной 35-180 нм., а также из особой популяции изогнутых микротрубочек. Цитоскелет тесно связан с синаптическими пузырьками. Взаимосвязь синаптических пузырьков с цитоскелетом осуществляется посредством белков синапсинов I и II и регулируется ионами кальция/кальмодулином. Синапсины I и II – фибриллярные фосфопротеины, встроенные в мембрану синаптических пузырьков. Они как бы пронизывают двойной липидный слой мембраны. Синапсин I способен взаимодействовать со многими белками цитоскелета терминали – актином, тубулином, спектрином и белками нейрофиламентов. Особое заначение имеет его связь с актином (белок участвует также в связывании полимеризации глобулярного актина в фибриллу). При фосфорилировании синапсина I кальций/кальмодулин зависимой протеинкиназой II происходит егго высвобождение из мембраны синаптического пузырька и соотвественно ослабление связи пузырька с актиновым цитоскелетом, что и позволяет ему начать перемещение к активной зон синапса. Именно синапсин I обеспечивает поддержание резервного пула синаптических пузырьков в стороне от активной зоны. Синапсин II не способен фосфорилироваться кальций/кальмодулин зависимой протеинкиназой II. Он не участвует в в быстрых процессах в пресинапсе, как синапсин I, и имеет значение в более мебленных и длительных изменениях в пресинапсе. Размеры ПП варьируют в широких пределах:

высота – от 30 до 80 нм, ширина – от 35 до 100 нм (рис. 2, 4). В среднем на один синапс ЦНС приходится около 16 ПП, которые фиксируются к внутримембранным, гексагонально расположенным, белковым якорным частицам пресинаптической мембраны (молекулы кадхеринов) с помощью белков - спектрина и катенина.
В районе активной зоны синапса было идентифицировано три основных белковых комплекса. Ключевой SNARE – комплекс, включает синтаксин, синапсин, синаптобревин (VAMP), синаптосомально ассоциированный белок -25 (SNARE-25). Этот комплекс обеспечивает подход (docking) и слияние (fusion) СП с пресинаптической мембраной. Второй белковый комплекс, включающий белки, MUNK-18, MUNK-13 и синаптотагмин, взаимодействует с мембранным комплексом SNARE-25 и регулирует экзоцитоз синаптических пузырьков. Третий комплекс имеет вариабельный состав, но обычно включает белки: Piccolo, Bassoon, Rab-3 – взаимодействующие белки (RIMs), динамин и др. Этот комплекс предназначен для формирования цитоматрикса активной зоны, который связывается, с одной стороны, с СП и, с другой, с мембранными механизмами, обеспечивающими экзо- и эндоцитоз. (Zhen,Jin,2004)
Белки пресинаптического цитоматрикса активной зоны: CASK, Munc-13, Rim, Piccolo/Aczonin и Basson выполняют функцию адаптеров, взаимодействуя с молекулами межклеточной адгезии, мембранными ионными каналами/рецепторами, а также включаясь в механизмы секреции медиаторов. Эти белки функционально взаимодействуют с пресинаптическим рецепторным аппаратом и могут регулировать процесс быстрого высвобождения нейротрансмиттера. Структурно располагаясь по краям ПП пресинаптической решетки, начиная от ее вершины в последовательности - Piccolo, Basson, Rim, CASK и Munc-13, эти белки представляют своеобразный каскад, обеспечивающий перемещение СП из проксимального пула (на вершинах ПП) в зону реализации. Этот цитоматрикс в терминале простирается вдоль контакта и называется цитоматриксом активной зоны контакта (АЗК).
Пресинаптическая мембрана активной зоны контакта, без учета размеров парамембранных филаментозных образований цитоскелета, на 10% тоньше мембраны других отделов терминали и отличается от них содержанием различных мембранных фосфолипидов, ганглиозидов, цереброзидов. Кроме белков фиксации цитоскелета пресинаптическая мембрана содержит различные рецепторные, специфические и неспецифические транспортные белковые комплексы (транспортеры), системы захвата и инактивации свободных нейромедиаторов, потенциалзависимые и потенциалнезависимые ионные каналы, молекулы межклеточной адгезии. Наличие большого количества кальциевых потенциалзависимых ионных каналов разного типа, быстро и резко изменяющих проницаемость мембраны для ионов кальция при ее деполяризации, приводит к входу в терминаль ионов кальция, повышению его внутриклеточного уровня и как следствие - инициации процесса секреции нейромедиатора/ов.
В пресинаптических окончаниях имеются также разнообразные метаботропные рецепторы (связанные с G-белком или обладающие тирозинкиназной активностью), регулирующие потенциалнезависимые ионные каналы рецепторного комплекса через систему вторичных внутриклеточных посредников (цАМФ, цГМФ, инозитолфосфаты, арахидоновая кислота, диацилглицерол). Эти рецепторы могут быть ауторецепторами, взаимодействующими с нейромедиаторами, секретируемыми данным синапсом и осуществляющими обратную связь при их выделении, или гетерорецепторами, отвечающими на сигналы от других клеток нервной системы.
Пресинаптический контроль со стороны других нейронов может быть как возбуждающим, стимулирующим выделение нейромедиатора синапсом, так и тормозным, снижающим секрецию нейромедиатора, что сказывается на эффективности работы синапса. В пресинаптическом окончании есть также рецепторы, способные связывать нейротрофические факторы, нейротоксины, вирусы и лекарственные препараты. Значимыми компонентами плазмолеммы пресинаптического окончания являются транспортные системы обратного захвата нейромедиаторов или продуктов их метаболизма.
Важную роль в работе синапса принимают многочисленные молекулы медклеточной адгезии, среди которых следует отметить: катенины, кадхерины, молекулы иммуноглобулинового суперсемейства (фибронектин III, NCAM, OBCAM и др), спектрин, CASK, липрин-α, нектин, нейрексин, нейролигин, винкулин, эфрин и эфрин-рецепторы и ряд других (Yamagata et al, 2003).
Основными задачами адгезионных молекул в организации структуры и функции синапсов являются:
- обеспечение стабильности синаптического соединения
- обеспечение точности формирования контакта (target recognition)
- участие в формировании пре- и постсинаптических специализаций после формирования первичного синаптического контакта
- регуляция синаптической функции посредством влияния на форму и размеры синаптических контактов и шипиков. (Рис. Роль адгезионных молекул в синапсах).
В настоящее время установилось представление, согласно которому основная масса синаптических пузырьков (СП) в терминали сосредоточена в большом резервном пуле (зона «R»), находящемся на расстоянии 200 нм от активной зоны контакта, где СП прикрепляются к актиновым микрофиламентам с помощью синапсина (рис. 5). Зона «Р» терминали представлена небольшым пулом СП и расположена между зоной R и зоной выделения нейромедиатора, где СП связываются с цитоматриксом активной зоны и пресинаптической плазматической мембраной. Третий, активный пул СП (зона «А») непосредственно связан с активной зоной пресинаптической мембраны - именно здесь происходит экзоцитоз медиатора/ов.
Необходимо отметить, что основная масса СП образуются в теле нейрона в аппарате Гольджи, но в терминаль поступают, как правило, незрелые везикулы. Их окончательное созревание осуществляется только после первого экзо/эндоцитоза СП, в результате которого происходит сортировка белковых элементов мембраны СП. После этой своеобразной инициации СП участвует еще в 1000-2000 везикулярных циклах внутри терминали, а затем транспортируется обратно в тело нейрона для деградации.
Механизмы секреции нейромедиаторов. Нейротрансмиссия в синапсе инициируется увеличением концентрации внутриклеточного Са2+ от 100 нМ до 200 µМ в результате входа Са2+в терминаль через кальциевые каналы в течение 200 микросекунд после распространения потенциала действия на терминаль синапса. Многочисленные исследования показали, что только после перемещения СП в активную зону синапса и повышения в этой зоне концентрации Са2+ до 20-50 µМ, становится возможным экзоцитоз СП в участках пресинаптической решетки между ПП. Максимальная активность экзоцитоза происходит при повышении концентрации Са2+ в терминале до 190-200 µМ.
Секреция медиатора - очень быстрый процесс: освобождение содержимого СП происходит в течение 260 мкс с периодом нарастания около 60 мкс.
При активации синапса выделение нейромедиатора из СП осуществляется в три этапа: стыковка (docking), созревание/праймирование (activation/priming) и выделение/экзоцитоз медиатора (fusion) (рис. 6).
Секреция нейромедиаторов осуществляется с помощью экзоцитоза содержимого синаптических пузырьков в синаптическую щель. Механизм экзоцитоза мелких синаптических пузырьков изучен наиболее детально и установлено, что он принципиально не отличается от процесса экзоцитоза содержимого везикул в других клетках. В экзоцитозе маленьких синаптических везикул участвуют белки самих пузырьков, белки цитозоля и плазматической мембраны активной зоны.
Судьба мелких и больших гранулярных пузырьков принципиально различна. Нейропептиды синтезируются в перикарионе, упаковываются в большие пузырьки в комплексе Гольджи и током аксоплазмы доставляются в терминальные разветвления аксона. Мелкие синаптические пузырьки образуются в пресинаптических отделах аксонов и являются «динамическими» структурами, участвуя в «цикле синаптических пузырьков». Отдельные белки синаптических пузырьков синтезируются в перикарионе и доставляются быстрым аксотоком в терминальные ветвления аксонов. В разных пресинаптических окончаниях даже одной терминальной веточки аксона маленькие синаптические пузырьки различаются по составу мембранных белков, что обеспечивает уникальность каждого синапса.
Поведение больших синаптических пузырьков с нейропептидами и мелких с классическими нейромедиаторами также отличается при возбуждении пресинаптического окончания. Экзоцитоз больших пузырьков происходит при высокочастотном возбуждении пресинаптического аксона, а мелкие секретируют нейромедиаторы даже в ответ на одиночные импульсы.
В «цикле синаптических пузырьков» выделяют несколько стадий. На стадии «стыковки» синаптические пузырьки находятся на расстоянии меньше своего диаметра от плазматической мембраны, однако без прохождения следующей стадии «созревания» они не способны к экзоцитозу в ответ на повышение уровня Cа2 В процессе созревания формируется так называемый «ядерный комплекс» из двух белков плазматической мембраны (синтаксина и SNAP-25) и одного белка мембраны пузырька (синаптобревина/VAMP). Образовавшийся ядерный комплекс служит рецептором для SNAP и фактора роста нервов (NSF). Повышение содержания ионов Cа2 при возбуждении пресинаптического окончания приводит к полному слиянию мембран и экзоцитозу содержимого везикул. Действие Cа2 связано с его влиянием на белок мембраны синаптических пузырьков – синаптотагмин. Большое значение для полного слияния мембран имеет NSF, который за счет энергии АТФ «разрывает» образовавшийся белковый ядерный комплекс, что приводит к слиянию фосфолипидных слоев контактирующих мембран пузырька и плазматической мембраны и образованию поры.
Регулируемый экзоцитоз не является процессом «все или ничего» – у многих синаптических пузырьков первоначально формируется очень маленькая пора и выделяется только незначительная часть содержимого пузырька. Затем пора может находиться какое-то время в «нестабильном» состоянии и переходить из открытого в закрытое состояние и наоборот. Полагают, что это позволяет более точно коррелировать процессы электрического возбуждения и секреции химических веществ. Только часть синаптических пузырьков после завершения стадии созревания участвует в экзоцитозе, причем вероятность экзоцитоза одного синаптического пузырька в ответ на повышения уровня Cа2 при поступлении одного потенциала действия к пресинаптическому окончанию меньше 50%. Регулируют вероятность экзоцитоза пузырьков белки rab 3, действие которых противоположно влиянию сенсора Cа2 – синаптотагмина. Квантовое, регулируемое механизмами экзоцитоза, выделение нейромедиаторов связано, в основном, с «везикулярным» (инкапсулированным) пулом нейромедиаторов. По современным данным, при активации межнейрональных синапсов происходит одновременное Cа2 – зависимое выделение какого-то классического нейромедиатора (ГАМК, глютамат, ацетилхолин, катехоламины) и нейромодулирующих медиаторов пептидной природы. Кроме этого, существует фоновое выделение цитозольного (растворимого) нейромедиатора посредством диффузии (утечки) и специализированное Cа2 – зависимое выделение растворимого нейромедиатора путем транспортных трансмембранных белковых систем типа медиафорина.
Экзоцитоз одного СП можно рассматривать только как один непродолжительный (около миллисекунды) этап всего синаптического цикла (около 10-20 сек), обеспечивающий эффективное использование мембраны и устойчивое квантовое выделение нейромедиатора.
Таким образом, в полном синаптическом цикле выделяют несколько различных по продолжительности стадий: 1) приближение СП к активной зоне контакта и соединение СП с пресинаптической мембраной синапсов, 2) конформационные и биохимические изменения компонентов СП, увеличивающие способность СП связывать ионы Са2+ и вступать в процесс экзоцитоза, 3) собственно экзоцитоз, в результате которого происходит Са2+-зависимое слияние мембран СП и пресинаптической терминали и выделение нейромедиатора в синаптическую щель, 4) обратный захват медиатора, который осуществляется путем эндоцитоза, в результате которого образуются окаймленные клатрином (опушенные) везикулы с пониженным содержанием нейромедиатора, 5) этап перемещения окаймленных пузырьков в вглубь терминали, что сопровождается снижением рН в их полости и потерей клатринового окаймления, 6) слияние лишенных окаймления СП с эндосомами, 7) формирование новых синаптических пузырьков путем их отпочкования от эндосом, 8) наполнение вновь образованных СП нейромедиатором, 9) взаимодействие вновь образованных СП с цитоскелетом терминали (микротрубочками и актиновыми микрофиламентами) и началом перемещения СП к активной зоне синапса. Цикл замкнулся. Стадии 1-3 осуществляются очень быстро (микро-, миллисекунды), а стадии 5-9 – медленно (секунды).
В синапсах выявлены три основных варианта эндоцитоза: 1) восстановление везикул после экзоцитоза непосредственно из пресинаптической мембраны с последующим их слиянием с эндосомами и образованием новых рабочих СП; 2) восстановление больших участков мембраны посредством крупных и глубоких инвагинаций, которые отщепляются от пресинаптической мембраны с образованием эндосом, т.н. «компенсаторный эндоцитоз»; 3) "kiss and run" эндоцитоз, который, в отличие от первых двух, не сопровождается полным экзоцитозом содержимого СП и не требует участия клатринового комплекса.
Имеются данные о существовании быстрого и медленного эндоцитоза, а, следовательно, короткого и длинного пути рециклирования синаптических везикул. В результате первого пополняется пул СП, немедленно готовых к экзоцитозу, а в результате второго - резервный пул СП. Показано, что в процессе активации синапса (длительная потенциация) происходит ускорение пресинаптического везикулярного цикла и интенсифицируется использование резервного пула СП. В терминали синапса происходит своеобразное смещение в сторону увеличения количества потенциально "активных" СП, а, следовательно, и вероятности их экзоцитоза.
Минимальное время, необходимое для восстановления везикулы после экзоцитоза, составляет 15 секунд, в течение 1 минуты большинство СП используются повторно, но около 25% СП становятся способными к новому экзоцитозу только после 10 минут.
Постсинаптическая зона. Наряду с постсинаптической мембраной важнейшим структурным компонентом этой зоны является постсинаптическое уплотнение (ПУ). Индивидуальная организация ПУ различных синапсов зависит от наличия и степени выраженности трех его компонентов: а) однородного, отличающегося самой высокой электронной плотностью, образования, располагающегося сразу под постсинаптической мембраной; б) компонент со средней степенью электронной плотности; в) субсинаптические тела, выявляющиеся в виде дискретных образований округлой формы на равном расстоянии от постсинаптической мембраны. Последние формируют т.н. «постсинаптическую решетку».
Основная масса синапсов ЦНС имеет четко выраженные компоненты «а» и «б». Средняя толщина ПУ варьирует от 20 до 70 нм. ПУ имеет смешанный филаментозно-гранулярный состав. В основе строения всех компонентов ПУ лежит волокнистая сеть, структурно связанная с постсинаптической мембраной. При этом компонент «а» ПУ состоит из филаментов диаметром 4 нм, компонент «б» – из более рыхло расположенных филаментов диаметром 9 нм. Сеть из этих более толстых фибрилл пронизывает всю толщину ПУ, фиксируется в отдельных гексагонально расположенных участках к белковым внутримембранным якорным частицам постсинаптической мембраны (кадхеринам) с помощью спектрин-катенинового комплекса (рис. 8), распространяется на 100 нм вглубь и структурно объединяется с постсинаптическим цитоскелетом. Внутренняя организация филаментозных сетей ПУ неоднородна. ПУ построено так, что между субъединицами диаметром 18 нм, состоящих из тонких (4 нм) филаментов, располагаются короткие толстые ветвящиеся волокна и участки гранулярного материала. Скопления гранулярного материала отличаются по объему, форме и содержат биологически активные вещества, в том числе протеинкиназы и кальмодулин. ПУ имеет тесную структурную связь с шипиковым аппаратом и микротрубочками дендритов. Актиновые филаменты имеют большое значение в шипиках, где они могут участвовать в изменении их формы и в результате влиять на проведение возбуждения на основной ствол дендрита. В постсинаптической зоне аксодендритических синапсов часто выявляются скопления рибосом, митохондрии, а в аксошипиковых синапсах – аксиально расположенные пучки филаментов, укрепляющих структуру шипика и определяющие изменение его конформации.
Химический состав ПУ определяется наличием 15 основных и 10 минорных белков. Следует отметить высокую изменчивость структурных компонентов постсинаптических уплотнений, что может отражать разную эффективность синапса. Это связано с неодинаковым содержанием в этой области регуляторных белков нейрона.
В постсинаптической зоне различных синапсов выявлены такие белки, как актин, тубулин, фосфопротеин I, микротубулярный протеин с высокой молекулярной массой и два типа киназ, активируемых циклическим АМФ (семейство ассоциированных с мембраной гуанилаткиназ - MAGUKs) и кальмодулином (цАМФ- и кальмодулинзависимые протеинкиназы), белки PSD-95, SynGAP, GKAP, Homer и Shank (рис. 8). Протеинкиназы функционируют в тесном взаимодействии с эффекторными системами (аденилатциклазная, фосфолипазная) постсинаптических мембран, осуществляющими передачу сигнала в мозге. Вероятно, протеинкиназой постсинаптического уплотнения является Са2+/кальмодулинзависимая протеинкиназа II (CaMKII).
В различных синапсах соотношение вышеназванных компонентов постсинаптического уплотнения значительно отличается. Например, по содержанию основного белка постсинаптическое уплотнение синапсов (PSD-95) мозжечка в пять раз беднее, чем ПУ синапсов коры большого мозга.
Ключевыми каркасными белками постсинаптической части наиболее распространенных в головном мозге глутаматергических синапсов являются PZD-домены PSD-95/SAP90 из семейства ассоциированных с мембраной гуанилаткиназ (MAGUKs - membrane-associated guanylate kinases). PZD-домен PSD-95/SAP90 взаимодействует с С-терминалью субъединицы NR2 NMDA-рецептора и с молекулами клеточной адгезии нейролигинами, SH3-домен - с каинатными рецепторами, а GK-домен - обеспечивает связь с постсинаптическим цитоскелетным матриксом через белок, ассоциированный с гуанилаткиназой (GKAP). Весь этот комплекс белков связан также с метаботропными глутаматовыми рецепторами. Важнейшим компонентом постсинаптической зоны является белок, связанный с AMPA-рецепторами (GRIP/AMPA - glutamate-receptor-interacting protein/AMPA-R binding protein) (рис. 8).
Передача сигнала в глутаматергических синапсах осуществляется с помощью своеобразных рецепторно-трансмиттерных систем, каждая из которых представлена комплексом молекул рецептора NMDA и AMPA, CaM-KII, PSD-95 и SynGAP (белок, активирующий Ras-GTPазу) в постсинаптической зоне (рис. 8).
Через метаботропные глутаматные рецепторы передача сигнала обеспечивается посредством комплекса соответствующего рецептора, белков GKAP, Homer и Shank. Рецепторно-трансмиттерные системы локализуются в постсинаптической зоне напротив мест экзоцитоза СП (между плотными проекциями). При этом в непосредственной близости от места выделения медиатора локализуются ионотропные рецепторы. Метаботропные гутаматовые рецепторы (mGluR) располагаются по периферии ПСУ.
Топография и функционирование глутаматных ионотропных рецепторов зависят от взаимодействия между цитоплазматическими хвостами молекулы рецептора и PDZ-домена каркасных MAGUKs белков ПСУ (PSD-95/SAP90, GRIP, PICK), которые образуют специализированный комплекс вокруг каждого класса глутаматовых рецепторов, обеспечивая их закрепление на постсинаптическом цитоскелете и лимитируя подвижность. При этом NMDA-рецепторы относительно устойчиво интегрированы с ПСУ, а AMPA-рецепторы обладают значительной подвижностью.
Основная функция постсинаптической части синапса заключается в трансформации химического сигнала в возбуждающий (ВПСП) или тормозной (ТПСП) постсинаптический потенциал и в осуществлении электротонического распространения его на постсинаптический нейрон.
Реализация этих функций осуществляется за счет двух видов рецепторов – ионотропных и метаботропных. Это лигандзависимые рецепторы. Ионотропные рецепторы объединены в единый функциональный комплекс с ионселективными каналами и очень быстро регулируют ионный ток через мембрану. Метаботропные рецепторы, объединенные, в частности, с аденилатциклазой посредством ГТФ-связывающего внутримембранного G-белка, осуществляют регуляцию более

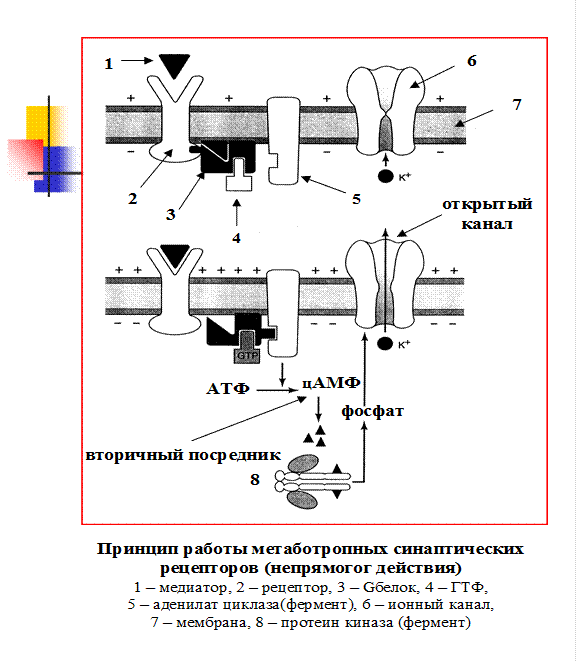
медленно, опосредованно через цАМФ и другие вторичные посредники и протеинкиназное фосфорилирование белков ионселективных каналов.
При длительной стимуляции метаботропных рецепторов в результате каскада внутриклеточных реакций, опосредуемых протеинкиназами, факторами транскрипции, активируются гены раннего ответа (в частности c-fos и c-jun), способствующие экспрессии структурных генов, что приводит к различным долгосрочным структурно-функциональным пластическим изменениям синапсов (гипертрофия, усложнение пространственной организации), что сопровождается усилением их эффективности. Увеличение локальной концентрации Ca2+ в постсинаптической зоне в результате открытия ионселективных Ca2+ каналов, связанных с ионотропными рецепторами типа NMDA, приводи
|
|
|


