 |
Такие данные послужили основанием считать, что
|
|
|
|
В зрелом мозге в СВЗ выделяют несколько типов клеток: мигрирующие нейробласты (клетки типа А); астроциты (тип B), предполагают что крупные клетки со светлыми ядрами в антенатальной СВЗ являются астроцитами типа B; нейральные предшественники, способные поддерживать свой пул (тип С); танициты (тип D); эпендимоцмиы (тип E). Клетки типа В, имеющие признаки астроцитов, в частрости экспрессирующие ГКФБ, является, как полагают, стволовыми клетками, способными давать начало обонятельным интернейронам.
Отсутствие глиогенеза в СВЗ зрелого мозга связывают с продукцией эпендимальными клетками белка Noggin, являющегося антагонистом ВМР (bone morphogenetic protein – костный морфогенный протеин). ВМР является важным фактором глиогенеза и в его отсутствие преобладают нейрогенные потенции стволовых клеток.
Развитие клеток нервной системы детерминировано во времени и пространстве. В частности, вначале образуются нейроны (у мышей нейрогенный период длится с 12 по 18 день эмбриогенеза) затем образуются астроциты (у мышей глиогенный период начинается с 18 суток эмбриогенеза, достигая максимума на первые (0-2) дни постнатального периода), а позднее олигодендроциты (максимум на 14 постнатальный день) (рис. 1). Аналогичная последовательность показана и в культуре клеток, где из стволовых клеток, полученных на 10-12 день эмбриогенеза, образуются нейроны, и только после нескольких дней культивирования начинают образовываться астроциты. Анализ клеточных клонов в культуре нейронов и в исследованиях in vivo с использованием ретровирусной метки было показано, что одна стволовая клетка может давать начало как нейронам, так и глиальным клеткам.
Многочисленные исследования гистогенетических потенций стволовых клеток показали два принципиальных положения, во-первых, что стволовые клетки имеют собственную программу реализации генетических потенций и, во-вторых, судьба стволовой клетки зависит и от внешних (по отношению к клеткам) воздействий. Последнее положения было ярко показано при культивации эмбриональных стволовых клеток (ЭСК). Когда ЭСК росли на срезах мозга, полученных из эмбрионов, они давали начало только нейронам, однако при культивировании со срезами постнатального мозга образовывались преимущественно астроциты. Напротив, стволовые/полустволовые клетки, изолированные из животных после их рождения, давали начало при инкубации на мозговых срезах эмбрионов только глиальным клеткам
|
|
|
Рис. 1. Последовательность дифференцировки клеток нервной системы in situ и in vitro у мышей. Пик нейрогенеза приходится на 14 – 16 сутки эмбриогенеза (Е14 – Е16). Пик астроглиогенеза приходится на первые сутки постнатального этапа развития (Р0 – Р3), а пик развития олигодендрогенеза – на 14 сутки постнатального развития (Р14). Аналогичная динамика показана и в культуре клеток in vitro.
В настоящее время выяснены некоторые молекулярные механизмы, определяющие дивергентную дифференцировку стволовых нейральных клеток.
Большое значение для судьбы нейрогенных стволовых клеток имеют цитокины семества IL-6, включающие цилиарный нейротрофический фактор (CNTF –ciliary neurotrophic factor), лейкемический ингибиторный фактор (LIF – leukemia inhibitor factor), кардиотропин-1 (CT-1 – cаrdiotrophin-1). Эти цитокины вызывают гетеродимеризацию и активацию β-субъединиц двух рецепторов LIFR и gp130 с последующей активацией многих внутриклеточных процессов, в том числе JAK-STAT пути (pathway), где JAK являются киназами, активирующимися gp130 рецептором, а STAT транскрипционными факторами, фосфорилирующимися и активирующимися JAK киназами.
|
|
|
Исскуственная экпрессия CNTF, LIF и CT-1 в эмбрионах приводила к «преждевременному» образованию астроцитов в раннем эмбриональном периоде, тогда как в контроле на этой стадии образовывались только нейроны. Образование астроцитов у «нокаут – мышей» по генам LIF и gp130 рецепторов было значительно снижено, а стволовые клетки, полученные из таких мышей, образовывали гораздо меньше астроцитов, чем клетки из нормальных мышей. Ингибирование STАT каскада также приводило к существенному снижение числа астроцитов как в культуре, так и in vivo.
Проастроцитарное действие транскрипционных факторов STAT объясняется тем, что они могут связываться с промоторами генов белков, типичных для астроцитов (в частности, ГКФБ и S100β) и активировать их транскрипцию. Трансактивация глиальных генов возможна только при взаимодействии STAT c коактиваторами p300 и CBP, обычно функционируюших в форме гетеродимера p300/CBP, и необходимыми для активизации многих транскрипционных факторов. Значение р300 для глиогенеза было показано в экспериментах с искусственным


повышением экспрессии р300, что значительно усиливало глиогенный эффект цитокинов.
Интересно, что нейрогенные транскрипционные факторы семейства bHLH, ответственные за дифференцировку нейронов (ngn1, ngn2 и Mash1), также связываются с p300/CBP, что уменьшает вероятность связывания STAT с p300/CBP и таким образом снижает уровень глиогенеза - это позволяет частично объяснить отсутствие глиогенеза в период развития нейронов.
Однако, большинство представленных выше результатов в отношении проглиального влияния цитокинов была получено в условиях культуры. In vivo CNTF и LIF экспрессируются только в постнатальном периоде и поэтому их влияние не может объяснить переключение стволовых клеток с нейронального на глиальный путь в эмбриогенезе. «Нокаут мыши» без этих цитокинов также не показали нарушений в образовании астроцитов. Напротив, CT-1 экспрессируется ранними нейронами в эмбриогенезе и полная блокада его экспрессии приводит к отсутствию развития астроцитов в культуре, а у нокаут ct-/- мышей наблюдается значительное снижение числа астроцитов.
Эти данные послужили основанием считать СТ-1 основным цитокином, ответственным за переключение нейрогенеза на глиогенез в эмбриональном периоде развития, а JAK-STAT важным путем, обеспечивающим этот глиогенез.
|
|
|
Кроме СТ-1 в астрогенезе большое значение имеют ростовой фактор BMP и рецептор Notch, частично действующие также через JAK-STAT путь. В семействе BMP наибольшее значение имеют факторы BMP2 и BMP4. В период нейрогенеза ВМР2 усиливает нейрогенез, а во время глиогенеза, напротив, способствуют развитию астроцитов.
Такое двойственное влияние ВМР2 объясняется тем, что они активируют транскрипционные факторы из семейства Smad (Smad 1,5 и 8), а они, в свою очередь, связываются с активированными STAT3 и p300/CBP.
Таким образом, в период активного глиогенеза, когда уровень ngn1 низкий, ВМР2 и глиогенные цитокины приводят к образованию комплекса Smad1:p300/CBP:STAT, способного трансактивировать глиогенные гены (в частности, ГКФБ, S100 бета), и одновременно к экспрессии ингибиторных HLH транскрипционных факторов (таких как Id1), которые могут ингибировать влияние нейрогенных факторов в стволовых клетках и таким образом способствовать развитию глиального фенотипа.
Напротив, в нейрогенный период при высоком уровне ngn1 воздействие ВМР2 приводит к образованию комплекса Smad:p300/CBP:ngn1, который ингибирует глиогенез вследствии: (1) уменьшения числа p300/CBP комплексов, свободных для связывания с STAT и (2) способности трансактивировать нейрональные гены.
Влияние рецептора Notch объясняется тем, что при его активации происходит отделение (отщепление) внутрицитоплазматической части (т.н. NICD Notch intracellular domain – Notch внутриклеточный домен), которая переносится в ядро, где взаимодействует с белком RBP-Jκ c образованием активного транскрипционного фактора, который вызывают транскрипцию ингибиторного гена hes из семейства bhlh, что приводит к ингибированию нейрогенеза и способствует поддержанию недифференцированного фенотипа стволовых клеток. У нокаут животных без Notch рецептора наблюдается преждевременное развитие нейронов и быстрое истощение (снижение числа) стволовых клеток, в частности клеток радиальной глии.
Notch является значимым фактором глиогенеза. Такая способность Notch связана во первых с активацией белка RBP-Jκ, способного связываться с промоутером гена ГКФБ при одновременной активации JAK-STAT пути (если JAK-STAT путь не активирован RBP-Jκ связывается с NСoR (белок кофактор репрессии), который напротив репрессирует глиогенные гены) и во вторых с активацией Hes белков, которые блокируют нейрогенез во время образования нейронов, но активируют глиогенез в глиогенный период.
|
|
|
Следует отметить, что большинство данных получены в культуре и не все предложенные схемы можно проверить in vivo, поскольку выведенные нокаут-мыши по многим из вышеперечисленных белков, не жизнеспособны и погибают в раннем эмбриональном периоде.
Кроме внешних воздействий, описанных выше, большое значение имеют «внутренние» механизмы стволовых клеток. Одним из примеров могут служить результаты культивации стволовых клеток, полученных на ранних сроках эмбриогенеза. Как уже отмечалось, более «молодые» клетки, полученные из 10 дневных эмбрионов начинаются образовывать астроциты при более длительной инкубации в сравнении с клетками, полученными из 14 дневных эмбрионов. Одним из объяснений таких «внутренних часов» является метилирование ДНК. Оказалось, что участок промотера гена ГКФБ, с которым связывается STAT, метилирован в нейрогенный период и деметилирован во время реализации глиогенных потенций стволовыми клеками. Нокаут фермента ДНК метилтрансферы 1 (продукт гена dnmt1), ответственного за метилирование ДНК, приводит к уменьшению числа нейронов в мозге и астроглиозу. Кроме STAT сайта промоутера ГКФБ, гены ответственные за gp130-JAK-STAT глиогенный путь также метилированы во время образования нейронов, а во время образования астроцитов метилирование устраняется.
В настоящее время время считается, что основные клеточные типы нервной системы: нейроны, астроциты и олигодендроциты имеют специфические для их дифференцировки транскрипционные факторы. Так, для нейронов это некоторые представители семейства bHLH, для олигодендроцитов (и мотонейронов спинного мозга) это субсемейство bLHL Olig, для астроцитов, кроме STAT и RBP-Jκ, это семество NF1 (nuclear factor-1 -ядерный фактор-1), а также NF1-A, -B, -C и –X. Значение NF1 для астроцитов стало выясняться после обнаружения того, что промоутер ГКФБ имеет сайт активно связывающий NF1. Двойной нокаут генов nf1-a -/- и nf1-b -/- приводит к существенному снижению числа астроцитов в мозге.
Развитие олигодендроцитов ЦНС в целом остается менее изученным в сравнении с астроцитами. Большинство олигодендроцитов в спинном мозге (где олигодендрогенез изучен лучше в сравнении с передним мозгом) развивается из вентральных отделов, преимущественно из домена pMN (рис. 2). Это связано с индукционным влиянием хорды и базальной пластинки нервной трубки, секретирующих особый белок sonic hedgehog (SHH), (дословный перевод – звуковой ежик –ежик потому что когда впервые увидели как ведут себя мушки дрозофилы с мутацией этого белка они напоминали ежика – sonic добавили когда установили мутацию у млекопитающих в честь героя детской игры – сейчас врачи попадают в сложные ситуации, когда приходится объяснять родителям, что врожденная патология связанная с нарушением образования этого белка имеет такое название так как она ассоциируется с героем детских игр и выглядит все не очень красиво – даже думают изменить название – все это пишем к тому, что дословного переводя быть не может и английские названия в биологии и медицине сейчас, как латынь раньше – надо просто использовать термины на английском языке чтобы было всем понятно) активирующий транскрипционные факторы Nkx 6 и Nkx 2.2. В свою очередь Nkx активируют субсемество Olig (преимущественно Olig2). Экпрессия Olig2 является непременным условием для развития олигодендроцитов и моторных нейронов спинного мозга и проявляется наиболее ярко в домене (сегменте) pMN. Нокаут мыши без Nkx6 практически полностью лишены олигодендроцитов и моторных нейронов в спинном мозге.
|
|
|
Дорзальная часть формирующегося спинного мозга находится под влиянием BMP, секретирующегося клетками верхней пластинки (крыши, roof plate) нервной трубки и способствующего развитию нейронов и астроцитов, а не олигодендроцитов. Несмотря на то, что ВМР не инициирует развитие олигодендроцитов, а SHH не способен диффундировать в дорзальную часть, олигодендроциты здесь все-таки образуются, что связывают с SHH независимым путем развития олигодендроцитов, возможно вследствие влияния FGF.
Рис. 2. Молекулярные основы дивергентной дифференцировки астроцитов (а) и нейронов (б).
а) Во время глиогенеза проглиогенные цитокины, преимущественно cardiotropin-1 (CT-1, кардиотропин-1) взаимодействуют с рецепторами LIFRβ и gp130, что приводит к их гетеродимеризации и активации JAK/STAT системы (большое значение имеет фосфорилирование транскрипционных факторов STAT (обозначено буквой р) JAK киназами). STAT связываются с коактиваторами CBP/p300 и одновременно с транскрипционными факторами Smad. Smad активируются вследствие того, что рецепторы с которыми связывается ростовой фактор ВМР (bone morphogenetic protein), обладают серин/треонин киназной активностью. Комплекс Smad1:p300/CBP:STAT обладает высоким сродством к промоутерам генов, ответственных за развитие глиального (астроцитарного) фенотипа, в частности ГКФБ и S100бета. Кроме того, ВМР приводит к экспрессии ингибирующего нейрогенез транскрипционного фактора Id1 (представителя, наряду с Hes, ингибиторов нейрогенеза из семейства bHLH). Активация Notch рецептора лигандами Delta и Jagged при контактом взаимодействии с соседними клетками (Delta и Jagged располагаются обычно в плазматическлй мембране) в это время приводит к образованию ингибитора нейрогенеза Hes и активации транскрипционного фактора RBP-J, способного прямо связываться с промоутером ГКФБ.
б) Во время нейрогенеза ВМР приводит к экспрессии пронейрогенных транскрипционных факторов ngn1,2 и mash (показан только ngn1,2), которые образуют комплеск с SMAD и CBP/p300, обладающим высоким сродством к промоутерам нейрогенных генов. Поскольку уровень активированного (фосфолирированного) STAT меньше чем ngn1,2, STAT проигрывает ngn1,2 в конкуренции за связывание с SMAD и CBP/p300. Отсутствие активации JAK/STAT пути приводит к тому (конкретные механизмы не выяснены) что проглиогенный фактор RBP-J связывается с репрессором NcoR и вследствие этого не может связываться с промоутером ГКФБ.
В переднем мозге предшественники олигодендроцитов (идентифицируемые по экспрессии PDGF Rα, Olig2, Olig1 и SOX10) начинают образовываться на 12,5 сутки эмбрионального развития в СВЗ медиальной ганглиозной эминенции (medial ganglionic eminence) откуда они мигрируют и к 18 суткам распространяются по всей коре (следует отметить, что находящиеся в коре предшественники не дифференцируются или дифференцируются только в минимальной степени в зрелые олигодендроциты). Несколько позже (14-15 сутки эмбриогенеза) начинается образование предшественников олигодендроцитов в латеральной эминенции, а в постнатальном периоде предшественники начинают образовываться и в СВЗ, прилегающей к формирующейся коре (рис. 3). Такая динамика соответствует градиенту распространения предшественников в спинном мозге. Интересно, что первые предшественники, образовавшиеся в медиальной эминенции, быстро погибают апоптозом и основная масса одигодендроцитов в коре мозга имеет дорзальное происхождение.
Рис. 3. Развитие олигодендроцитов в спинном (а) и головном (б) мозге. С изменениями по W.D.Richardson et al. (2006).
а) Схематическое изображение развивающегося из нервной трубки спинного мозга. Нейроэпителий вентрикулярной зоны подразделен на участки - домены р3, pMN, p2, p1, p0, dP6, dP5, dP4, dP3, dP2, dP1, отличающихся неодинаковой экпрессией транскрипционных факторов (показаны в левой части). Разная экспрессия этих траснкрипционных факторов приводит к тому, что в разных доменах образуются разные типы клеток и в разной время и кроме того анализ экспрессии этих факторов позволяет определить с какого домена образованы те или иные клетки. Вентральная часть развивающего спинного мозга находится под влиянием ростового фактора (морфогена) sonig hedgehog (SHH), способствующего развитию моторных нейронов и олигодендроцитов, а в дорзальной части проявляется влияние другого ростового фактора BMP (bone morphogenetic protein), способствующего развитию интернейронов и астроцитов.
б) В переднем мозге предшественники олигодендроцитов вначале развиваются из медиальной эминенции (1), несколько позже из латеральной эминенции (2) и только постнатально они начинают образовываться из субвентрикулярной зоны формирующейся коры (3). Такая динамика развития клеток во многом соответствует формированию олигодендроциттов в спинном мозге (правая часть).
Достижения в области изучения стволовых клеток значительно расширили представления о стадийности развития нейральных предшественников в направлении нейроглии в условиях культуры. Процесс дифференцировки зрелых форм из ранних предшественников (нейроэпителия и радиальной глии) происходит через промежуточные клеточные формы с сужающими проспективными потенциями в естественной среде in situ. В культуре при соответствующих условиях многие незрелые формы клеток могут восстанавливать свои плюрипотентные свойства. Наглядным примером влияния микроокружения на потенции клеток могут служить стромальные клетки костного мозга, которые попадая с током крови в головной мозг способны превращаться в нейроны и клетки макроглии.
В условиях культуры известны несколько типов нейроглиальных предшественников.
Предшественник глиальных клеток (ПГК) (glial restricted precursor – GRP) определяется раньше других типов предшественников в эмбриогенезе – у мышей с 12 суток эмбриогенеза. В отличие от нейроэпителиальных клеток ПГК экпрессируют гликопротеид А2В5, а в отличие от предшественника О2А они способны образовывать не только олигодендроциты, но и астроциты, однако не экспрессируют NG2 и PDGF Rα.
О2А предшественник был изолирован одним из первых из перинатального зрительного нерва крысы и позже был выделен из других отделов мозга. О2А экспрессируют А2В5, NG2 и PDGF Rα. Под воздействием PDGF и FGF они способны делиться большое число раз и не претерпевают старения в культуре в отличие от большинства других соматических клеток. В культуре они генерируют олигодендроциты и астроциты второго типа, отличающиеся от астроцитов первого типа экспрессией А2В5. Следует отметить, что аналога астроцитам второго типа in situ не известно.
NG2 клетки (полидендроциты) характеризуются экспрессией NG2 и PDGF Rα. Они считаются основными предщественниками олигоденлроцитов в период развития, и могут давать начало нейронам и астроцитам. NG2 клетки составляют многочисленную популяцию и в зрелой нервной системе (см. Раздел по NG2 клеткам), однако их отличие (если имеется) от эмбриональных NG2 клеток не известно, также не выясненным остается их соотношение с ПГК и О2А предшественниками.
MNOP (motorneuron-oligodendrocyte precursors) – выделение этого типа предшественников основано на результатах анализа активации (gain-of-function) и ингибиции (loss-of-function) функции транскрипционных факторов Olig 1 и Olig 2. Полагают, что этот предшественник является источником олигодендроцитов и моторных нейронов спинного мозга и возможно имеется в головном мозге.
Имеются описания нескольких других предшественников выделенных из разных отделов ЦНС и в разное время онтогенеза.
Следует отметить, что в последнее время традиционные термины глиобласт, астробласт и олидендробласт практически не используются, поскольку проспективные потенции названных так клеток не известны, а корелляция с современными представлениями о развитии клеток отсутствует.
Основная часть популяции глиальных клеток формируется после завершения нейроногенеза. Начало постнатального глиогенеза совпадает с окончанием пролиферации нейронов и началом их дифференцировки. Пролиферация глиальных клеток активируется раньше в спинном мозге, затем в головном. При этом в эмбриогенезе и постнатальном онтогенезе олигодендроциты дифференцируются позже, чем астроциты. Дифференцировка глиальных клеток происходит в тесном метаболическом и трофическом взаимодействии с нейронами в виде единого нейроглиального комплекса.
В процессе развития макроглии выделяют стадии: 1) недифференцированных матричных клеток (вентрикулярные, экстравентрикулярные и субвентрикулярные клетки); 2) первичной дифференцировки (астробласты и олигодендробласты); 3) окончательной дифференцировки (зрелые астроциты и олигодендроциты).
Дифференцировка миелинобразующих ШК ПНС последовательно включает в себя этапы: клетка нервного гребня ® ранняя клетка-предшественница ШК ® коммитированная ШК ® ШК премиелинового фенотипа ® миелинобразующая ШК. Первые этапы дифференцировки миелиннеобразующих ШК, включая коммитированную ШК, являются общими с этапами развития миелинобразующих ШК, а затем формируются про-предшественник, далее – миелиннеобразующая ШК. Для каждого этапа дифференцировки ШК характерен определенный набор экспрессируемых биологически активных веществ. На ранних этапах эмбриогенеза экспрессируются рецепторы фактора роста нервов (LNGFR), белок, связанный с ростом (GAP-43, или нейромодулин), молекулы адгезии нервных клеток (N-CAM) и молекулы адгезии из семейства иммуноглобулинов L1 (Ng-CAM), белок S-100. На промежуточных этапах дифференцировки включается синтез транскрипционных факторов из семейства POU, транскрипционных факторов из семейства белков цинковых пальцев Krox-20, белки миелина и галактоцереброзид (GalC). Миелинобразующая ШК экспрессирует белок S-100, Krox-20, белки миелина и GalC. Активация генов белков миелина совпадает с исчезновением митозов ШК. Экспрессия гена P0(маркер периферического миелина) характерна для ранних предшественников ШК и начинается задолго до образования миелина.
Полипотентные матричные клетки, являющиеся источником эпендимных клеток, в процессе дифференцировки под воздействием факторов микроокружения разделяются на эпителиоидные (типичные) эпендимные клетки и эпендимные танициты. Все глиальные клетки в постнатальном периоде сохраняют способность к пролиферации.
Если обобщить современные представления о развитии нейронов, становится очевидным, что важнейшим этапом дифференцировки нервных элементов является начало синтеза нейромедиаторов непосредственно в составе их перикариона и формирующихся отростков. Параллельно происходит гетерохронный процесс образования холино-, адрено- и других рецепторов на мембранах клеток-мишеней. Представление о медиаторном этапе онтогенеза нервной системы было сформулировано нами с выделением ряда его последовательных стадий в течение пре- и постнатального периодов развития.
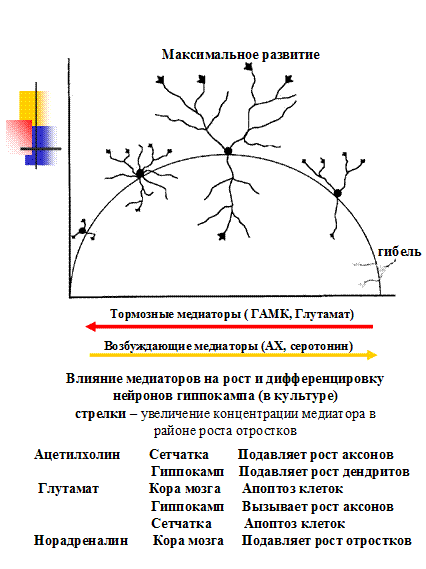
Гистогенез нервной ткани протекает по принципу «избыточного» формирования как числа самих нейронов, так и количества и степени разветвления их отростков и, соответственно, числа синаптических контактов. Первоначально это особенно выражено в высших, эволюционно молодых отделах центральной нервной системы (ЦНС). Здесь образуется значительно больше клеток, чем впоследствии их сохраняется (ко времени половой зрелости по разным оценкам число нейронов уменьшается на 20-80%). Аналогичная закономерность характерна и для количества разветвлений и веточек дендритов и аксонов и числа синаптических контактов. Например, подсчитано, что у обезьян макак-резусов в период полового созревания теряется около 50% всех синапсов в зрительной коре, и в среднем в коре животных исчезает около 30 000 синапсов каждую секунду.
Определяющим фактором сохранения нейронов в процессе развития нервной системы является поступающая к ним «афферентная информация» в виде: 1) химических (трофических) агентов – факторов роста (особенно важно для развития аксона и выживания самих клеток); 2) функциональной (электрической) активности – необходимого условия поддержания степени арборизации дендритов, сохранности синапсов и развития глиоцитов, окружающих нейроны (рис. 9.4). Наиболее изученными среди большого числа ростовых факторов нервной ткани (так называемое семейство нейротропинов) являются фактор роста нервов, «мозговой» и цилиарный факторы роста.
Электрическая активность имеет огромное значение для развития нейронов и приобретения ими дефинитивного фенотипа. Это связано с тем, что окончательного развития нервная система (а значит, и нервная ткань) у позвоночных (в отличие от беспозвоночных) достигает при переходе ко внеутробной жизни, когда основными источниками возбуждения нейронов становятся органы чувств. Таким образом, зрелая структура нервной системы определяется во многом внешними по отношению к организму влияниями, что и приводит к уникальности нервной системы каждого биологического индивидуума. Постоянная электрическая активность определяет сохранность синапсов и эффективность передачи возбуждения в них. Синаптическая активность, означающая функционирование клетки в составе рефлекторной дуги, в свою очередь, способствует поддержанию жизнедеятельности и выживанию нейронов. Конкретным внутриклеточным субстратом такого влияния являются регуляторные ферментные системы, в первую очередь, протеинкиназы и факторы транскрипции, активирующиеся повышением внутриклеточного уровня ионов кальция/кальмодулина

Прогресс в познании структуры генов, ответственных за синтез белков и плазмолеммальных рецепторов, возможность клонирования этих генов позволяет проводить иммуногистохимическую идентификацию и определять локализацию их матричной РНК в клетке. В настоящее время известно большое число генов, определяющих развитие элементов нервной системы. Получены трансгенные животные со стабильными мутациями, затрагивающими разные структуры нервной системы. Так, у мутантных мышей «reeler» выявлены нарушения формирования цитоархитектоники коры больших полушарий и мозжечка, что находит свое отражение в поведении животных. Особенно детально генетическая предопределенность в судьбе нейронов выражена у беспозвоночных. У мушки дрозофилы выявлены нейрогенные гены (в частности Notch, Delta), имеющие огромное значение для гистогенеза нервной ткани. Аналогичные гены идентифицированы также у позвоночных, и можно надеяться на выяснение в будущем их роли в развитии и деятельности нервной системы у человека.
Наглядным примером внешних воздействий на развитие нервной системы могут служить эксперименты с разными условиями содержания животных. Животные (крысы, кошки), воспитанные в условиях «обогащенной» внешней среды (тренировки в лабиринте, постоянная двигательная активность), имеют бо’льшую массу мозга и более развитое серое вещество коры больших полушарий по сравнению с контрольными. Возрастание этих показателей происходило не вследствие увеличения числа нейронов, а в результате усиления степени арборизации их отростков.
Кроме генетических и эпигенетических влияний ряд процессов гистогенеза нервной системы имеет вероятностный характер. Так, по наблюдениям в культуре клеток, выделение аксона из многих других растущих отростков нейрона имеет случайный характер, и аксоном становится самый длинный и активно формирующийся в конкретный момент времени отросток.
Важнейшая проблема возрастных преобразований и инволюции нейронов связана с синтезом медиаторов и способностью к их захвату. Известна значительная убыль количества нервных клеток в составе спинномозговых и вегетативных ганглиев в различных отделах ЦНС. Гибели нейронов предшествует нарушение синтеза медиаторов в перикарионе и отростках. Происходит лавинообразное нарушение адаптационно-трофических влияний на деятельность важнейших внутренних органов и нарушение функционирования нервных центров.
Литература (новая)
Беспалов А.Ю., Звартау Э.Э. Нейропсихофармцкология антагонистов NMDA-рецепторов. – СПб.: Невский Диалект, 2000. – 297 с.
Зефиров А.Л. Везикулярный цикл в пресинаптическом окончании // Российский физиологический журнал. – 2007. – Т.93, N5. – С. 544-562.
Калиниченко С.Г., Мотавкин П.А. Кора мозжечка. - М.: Наука, 2005. - 319 с.
Семченко В.В., Боголепов Н.Н., Степанов С.С., Максимишин С.В., Хижняк А.С. Синаптическая пластичность неокортекса белых крыс при диффузно-очаговых повреждениях головного мозга // Морфология. – 2005. – Т.128, № 4. – С. 76-81.
Фрумкина Л.Е., Хаспеков Л.Г. Молекулярные механизмы развития и организации постсинаптического отдела глутаматергических синапсов в центральной нервной системе // Нейрохимия. – 2005. – Т.22, №4. – С. 245-265.
Фрумкина Л.Е., Хаспеков Л.Г. Современные представления о развитии химических синапсов и молекулярных механизмах синаптогенеза в центральной нервной системе // Нейрохимия. – 2003. – Т.20, №3. – С. 165-178.
Aakalu G., Smith W.B., Jiang, C. et al. Dynamic visualization of dendritic protein synthesis in hippocampal neurons // Neuron. – 2001. – V.30. – P. 489-502.
Abbott L.F., Regehr W.G. Synaptic computation // Nature. – 2004. – V.431, N7010. – P.796-803.
Arcangeli A., Becchetti A. Complex functional interaction between integrin receptors and ion channels // Trends Cell Biol. – 2006. – V.16, N12. – P.631-639.
Auld D.S., Robitaille R. Glial cells and neurotransmission: An inclusive view of synaptic function // Neuron. – 2003. – V. 40. – P. 389-400.
Barres B.A., Chun L.L.Y., Corey D.P. Ion channels in vertebrate glia // Annu. Rev. Neurosci. – 1990. – V.13. – P.441-474.
Bayona N.A., Bitensky J., Teasell R. Plasticity and reorganization of the uninjured brain // Top Stroke Rehabil. – 2005. – V.12, N3. – P.1-10.
Bazan N.G. Lipid signaling in neural plasticity, brain repair, and neuroprotection // Mol Neurobiol. – 2005. – V.32, N1. – P.89-103.
Brittis P.A., Lu Q., Flanagan J.G. Axonal protein synthesis provides a mechanism for localized regulation at an intermediate target // Cell. – 2002. – V.110. – P. 223-235.
Calabrese B., Wilson M.S., Halpain S. Development and regulation of dendritic spine synapses // Physiology (Bethesda). – 2006. – V.21. – P.38-47.
Carlisle H.J., Kennedy M.B. Spine architecture and synaptic plasticity // Trends Neurosci. – 2005. – V.28, N4. – P.182-187.
Chevaleyre V., Takahashi K.A., Castillo P.E. Endocannabinoid-mediated synaptic plasticity in the CNS // Annu Rev Neurosci. – 2006. – V.29. – P.37-76.
Cocucci E., Lorusso A., Ongania G.N. et al. Non-secretory exocytoses in the brain // J Physiol Paris. – 2006. – V.99, N 2-3. – P.140-145.
Dobkin B.H. Neurobiology of rehabilitation // Ann N Y Acad Sci. – 2004. – V.1038. – P.148-170.
Duman J.G., Forte J.G. What is the role of SNARE proteins in membrane fusion? // Am. J. Physiol. Cell Physiol. – 2003. – V.285. – P. C237-C249.
Ebihara T., Kawabata I., Usui S. et al. Synchronized formation and remodeling of postsynaptic densities: long-term visualization of hippocampal neurons expressing postsynaptic density proteins tagged with green fluorescent protein // The Journal of Neuroscience. – 2003. – V.23, N6. – P. 2170 -2181.
Fenster S.D., Chung W.J., Zhai R. et al. Piccolo, a presynaptic zinc finger protein structurally related to bassoon // Neuron. – 2000. – V. 25. P. 203-214.
Fiala J.C. Reconstruct: a free editor for serial section microscopy // Journal of Microscopy. – 2005. – V. 218, N 1. – P. 52-61.
Fields R.D., Stevens-Graham B. New insights into neuron-glia communication // Science. – 2002. – V.298. – P. 556-562.
Garcia-Junco-Clemente P., Linares-Clemente P., Fernandez-Chacon R. Active zones for presynaptic plasticity in the brain // Mol Psychiatry. – 2005. – V.10, N2. – P.185-200.
Garner C.C., Nash J., Huganir R.L. PDZ domains in synapse assembly and signalling // Trends Cell Biol. - 2000. - V.10, N7. - P.274-280.
Gerrow K., El-Husseini A. Cell adhesion molecules at the synapse // Front Biosci. – 2006. – V. 11. – P.2400-2419.
Giuditta A., Koenig E. Protein synthesis in axons and terminals: significance for maintenance, plasticity, and regulation of phenotype. With a critique of slow transport theory // Prog. Neurobiol. – 2000. – V. 62. – P. 1-62.
Groc L., Gustafsson B., Hanse E. AMPA signalling in nascent glutamatergic synapses: there and not there! // Trends Neurosci. – 2006. – V.29, N3. – P.132-139.
Grutzendler J., Gan W.B. Two-photon imaging of synaptic plasticity and pathology in the living mouse brain // NeuroRx. - 2006. - V.3, N4. - P.489-496.
Harvey A.R., Kendall C.L., Sykova E. The status and organization of astrocytes, oligodendroglia and microglia in grafts of fetal rat cerebral cortex // Neurosci. Lett. – 1997. – V.228, N1. – P.58-62.
Haydon P.G., Carmignoto G. Astrocyte control of synaptic transmission and neurovascular coupling // Physiol Rev. – 2006. – V.86, N3. – P.1009-1031.
Iino M., Goto K., Kakegawa W. et al. Glia-synapse interaction through Ca2+-permeable AMPA receptors in Bergmann glia // Science. – 2001. – V.292. – P. 926-929.
Kennedy M.J., Ehlers M.D. Organelles and trafficking machinery for postsynaptic plasticity // Annu Rev Neurosci. – 2006. – V.29. – P.325-362.
Kidokoro Y. Roles of SNARE proteins and synaptotagmin I in synaptic transmission: studies at the Drosophila neuromuscular synapse. Neurosignals. – 2003. – V.12. – P. 13-30.
Marrone D.F., Petit T.L. The role of synaptic morphology in neural plasticity: structural interactions underlying synaptic power // Brain Research Reviews. – 2002. – V.38. – P. 291-308.
McAllister A.K., Stevens C.F. Nonsaturation of AMPA and NMDA receptors at hippocampal synapses. Proc. Natl. Acad. Sci. USA. – 2000. – V.97. – P. 6173-6178.
Ming G.L., Song H. Adult neurogenesis in the mammalian central nervous system // Annu Rev Neurosci. – 2005. – V.28. – P.223-250.
Montgomery J.M., Zamorano P.L., Garner C.C. MAGUKs in synapse assembly and function: an emerging view // Cell Mol Life Sci. – 2004. – V.61, N7-8. – P.911-929.
Morgan J.R., Augustine G.J., Lafer E.M. Synaptic vesicle endocytosis: the races, places, and molecular faces // Neuromolecular Med. – 2002. – V.2. – P. 101-114.Murthy V.N., De Camilli P., 2003
Oertner T.G., Matus A. Calcium regulation of actin dynamics in dendritic spines // Cell Calcium. – 2005. – V.37, N5. – P.477-482.
Phillips G.R., Huang J.K., Wang Y. et al. The Presynaptic particle web: ultrastructure, composition, dissolution, and reconstitution // Neuron. – 2001. – V. 32. – P. 63-77.
Rollenhagen A., Lubke J.H. The morphology of excitatory central synapses: from structure to function // Cell Tissue Res. - 2006. - V. 326, N2. - P.:221-237.
Slezak M., Pfrieger F.W., Soltys Z. Synaptic plasticity, astrocytes and morphological homeostasis // J Physiol Paris. – 2006. – V.99, N2-3. – P. 84-91.
Sonnewald U., Westergaard N., Schousboe A. Glutamate transport and metabolism in astrocytes // Glia. – 1997. – V. 21, N1. – P.56-63.
Sprengel R. Role of AMPA receptors in synaptic plasticity // Cell Tissue Res. – 2006. – V. 326, N2. – P.447-455.
Stevens C.F. Presynaptic function // Curr Opin Neurobiol. – 2004. – V.14, N3. – P.341-345.
Sudhof T.C. The synaptic vesicle cycle // Annu. Rev. Neurosci. – 2004. – V. 27. – P.509–547.
Sutton M.A., Schuman E.M. Dendritic protein synthesis, synaptic plasticity, and memory // Cell. – 2006. – V. 127, N1. – P.49-58.
Tada T., Sheng M. Molecular mechanisms of dendritic spine morphogenesis // Curr Opin Neurobiol. – 2006. – V.16, N1. – P.95-101.
Ullian E.M., Christopherson K.S., Barres BA. Role for glia in synaptogenesis // Glia. – 2004. – V.47, N3. – P.209-216.
Verkhratsky A., Orkand R.K., Kettenmann H. Glial calcium: homeostasis and signaling function // Physiol. Rev. – 1998. – V.78. – P. 99-141.
Woodbury D.J., Rognlien K. The t-SNARE syntaxin is sufficient for spontaneous fusion of synaptic vesivles to planar membranes // Cell Biology International. – 2000. – V. 24, N11. – P. 809-818.
Yamauchi T. Neuronal Ca2+/calmodulin-dependent protein kinase II-discovery, progress in a quarter of a century, and perspective: implication for learning and memory // Biol Pharm Bull. – 2005. – V.28, N8. – P.1342-1354.
Литература (старая из предыдущего издания)
Бабминдра В. П., Брагина Т. А. Структурные основы межнейронной организации.– Л.: Наука, 1982.
Корочкин Л. П. Нейрогенез и гены. Аналитические аспекты дифференцировки.– М.: Наука, 1991.– С. 28–56.
Лаврентьев Б. И. Теория строения вегетативной нервной системы.– М.: Медицина, 1983.
Оленев С. Н. Нейробиология.– СПб.: Наука, 1995.
Поляков Г. И. Основы систематики нейронов новой коры большого мозга человека.– М.: Медицина, 1973.
Ройтбак А. И. Глия и ее роль в нервной деятельности.– СПб.: Наука, 1993.
Семченко В. В., Степанов С. С. Система субсинаптических единиц как универсальный системообразующий и регулирующий фактор синапсов головного мозга// БЭБМ.– 1997, № 7.– С. 4–12.
Сосунов А. А., Чучков В. М. Концепции и принципы организации нервной системы// Рос. Морф. Вед.– 1995, № 1.– С. 57–61.
Сотников О. С. Динамика структуры живого нейрона.– Л.: Наука, 1985.
Сотников О. С. Функциональная морфология живого мякотного нервного волокна.– Л.: Наука, 1976.
Сотников О. С., Богута К. К., Голубев А. И., Миничев Ю. С. Механизмы структурной пластичности нейронов и филогенез нервной системы.– СПб.: Наука, 1994.
Шаде Дж., Форд Д. Основы неврологии: Пер. с англ.– М.: Мир, 1976.
Швалев В. Н., Сосунов А. А., Гуски Г. Морфологические основы иннервации сердца.– М.: Наука, 1992.
Шеперд Г. Нейробиология (в двух томах): Пер. с англ.– М.: Мир, 1987.
Alberts B., Bray D., Lewis J., Raff M., Roberts K., Watson J. D. Molecular biology of the cell. 3rd ed. - New York, London: Carland Publ., Inc., 1994.
Benninghoff Anatomie. Makroskopishe Anatomie, Embryologie und Histologie des Menschen. Bd. 2/ Herausg. D. Drenckhahn und W. Zenker. Munchen – Wien – Baltimore: Urban & Schwarzenberg, 1994.
Benveniste E. N. Role of macrophages/microglia in multiple sclerosis and experimental allergic encephalomyelitis// J. Mol. Med.– 1997.– V. 75.– P. 165–173.
Bern H. A., Knowles F. G. W. Neurosecretion. In: Neuroendocrinology/ eds. L. Martini, W. F. Ganong.– New York: Academic Press, 1966.– V. 1.– P. 139–186.
Bloom F. E. Contrasting principles of synaptic physiology: peptidergic and non-peptidergic neurons// Central Regulation of the Endocrine System/ Eds. K. Fuxe, T. Hцkfelt, R. Luft.– New York: Plenum Press, 1979.– P. 173–187.
Cajal y Ramon S. Histologie du systeme nerveux de l’homme et des vertebres. 2 vols.– Paris: Maloine, 1909, 1911.
Dermietzel R., Farooq M., Kessler-J. A., Althaus H., Hertzberg E. L., Spray D. C. Oligodendrocytes express gap junction proteins connexin32 and connexin45// Glia.– 1997.– V. 20.– P. 101–114.
Fu S. Y., Gordon T. The cellular and molecular basis of peripheral nerve regeneration// Mol. Neurobiol.– 1977.– V. 14.– P. 67–116.
Garthwaite J. Neural nitric oxide signalling// TINS.– 1995.– V. 18.– P. 51–56.
Geppert M., Sьdhof T. C. Rab3 and synaptotagmin: the Yin and Yang of synaptic membrane fusion// Annu. Rev. Neurosci.– 1998.– V. 21.– P. 75–95.
Gray E. G. Gray’s Anatomy.– Edingburgh – London – Melbourne – New York: Longman, 1973.
Guillemin R. Peptides in the brain: the new endocrinology of the neuron (Nobel Lecture)// Science.– 1978.– V. 202.– P. 390–402.
Halata Z., Munger B. L. The ultrastructure of Ruffini and Herbst corpuscules in the articulate capsule of domestic pigeon// Anat. Rec.– 1980.– V. 198.– P. 681–692.
Harvey A. R., Kendall C. L., Sykova E. The status and organization of astrocytes, oligodendroglia and microglia in grafts of fetal rat cerebral cortex// Neurosci. Lett.– 1997.– V. 228.– P. 58–62.
Hirokawa N. Axonal transport and the cytoskeleton// Curr. Opin. Neurobiol.– 1993.– V. 3.– P. 724–731.
Linskey M. E. Glial ontogeny and glial neoplasia: the search for closure// J. Neurooncol.– 1997.–
|
|
|


