 |
Определение содержания свободной углекислоты
|
|
|
|
Ход работы:
1. В коническую колбу пипеткой внесите 100 мл анализируемой воды, сюда же добавьте 2-3 капли спиртовогораствора фенолфталеина, содержимое колбы перемешайте:
- если жидкость приобрела розовую окраску - это свидетельствует об отсутствии свободной углекислоты (обоснуйте это).
- если вода осталась бесцветной, то титруйте пробу раствором гидроксида натрия молярной концентрации 0,1 моль/л до тех пор, пока исчезающая вначале окраска не станет устойчивой, и жидкость приобретет розовый оттенок.
2. Рассчитайте содержание свободной углекислоты в воде по формуле:
V (NaOH)·c(NaOH)·44·1000
 c (CO2) =
c (CO2) =
V (пробы)
 |
с (СО2) - концентрация углекислого газа (мг/л);
с (NаОН) - концентрация гидроксида натрия (моль/л);
V (NaOH) - объем гидроксида натрия, пошедший на титрование(мл);
V (пробы) - oбъём пробы воды, взятой на исследование (мл);
44 - молярная масса углекислого газа.
Определение содержания карбонат-ионов.
Ход работы:
В коническую колбу пипеткой внесите 100 мл воды, добавьте 2-3 капли фенолфталеина, титруйте пробу раствором соляной кислоты молярной концентрации 0,05 моль/л до тех пор, пока проба не приобретет слабый розовый цвет.
Рассчитайте содержание карбонат-ионов в воде по формуле:
V(НCl)·c (HCl)·11·1000
 c (CO32-) =
c (CO32-) =
V (пробы)
c (CO32-) - концентрация карбонат-ионов (мг/л);
c (HCl) - концентрация соляной кислоты (моль/л);
V (НCl) - объём соляной кислоты, пошедший на титрование (мл);
V (пробы) - объем пробы воды, взятый на исследование (мл);
11 - коэффициент для пересчета на массу карбонат-ионов.
Определение содержания гидрокарбонат-ионов.
Ход работы:
В коническую колбу пипеткой внесите 100 мл, добавьте 2-3 капли раствора метилового оранжевого, титруйте пробу раствором соляной кислоты молярной концентрации 0,05 моль/л до появления устойчивого розового окрашивания.
|
|
|
Рассчитайте содержание гидрокарбонат-ионов в воде по формуле:
V(НCl)·c (HCl)·22·1000
 c (НCO3-) =
c (НCO3-) =
V (пробы)
c (НCO3-) - концентрация гидрокарбонат-ионов (мг/л);
c (HCl) - концентрация соляной кислоты (моль/л);
V (НCl) - объём соляной кислоты, пошедший на титрование (мл);
V (пробы) - объем пробы воды, взятый на исследование (мл);
22 - коэффициент для пересчета на массу гидрокарбонат-ионов.
(Лурье, 1984)
Контрольные вопросы
1. Какое существует равновесие между различными формами угольной кислоты?
2. Что называют стабильной, нестабильной, агрессивной водой?
3. Что такое индекс стабильности воды?
IV. ХИМИЯ ГИДРОСФЕРЫ
Лабораторная работа №1
Определение остаточного хлора
Теоретическая часть.
Классическое хлорирование является самым надежным способом обеззараживания, когда микробиологическое загрязнение воды является наиболее сильным. Внедрение хлорирования считается самым крупным событием в медицине XX века, остановившим распространение кишечных инфекций в городах. Хлорирование является обязательным при подаче воды в разводящую сеть.
При введении хлора в воду образуются хлорноватистая и соляная кислоты:
 С12+Н2О НС1О + НС1
С12+Н2О НС1О + НС1
В сильнокислой среде равновесие этой реакции сдвинуто влево и в воде присутствует молекулярный хлор; при значении рН более 4 последний практически отсутствует. Наиболее сильными бактерицидными свойствами обладает молекулярный хлор и хлорноватистая кислота.
Основными обеззараживающими веществами при хлорировании являются Cl2, HClO, ClO- («свободный активный хлор») и NH2Cl, NHCl2 («свзанный активный хлор»).
Моно- и дихлорамины образуются при наличии в воде аммонийных солей или аммиака:
HClO + NH3 = NH2Cl + H2O
HClO + NH2Cl = NHCl2 + H2O
Бактерицидные свойства хлораминов значительно ниже, чем у хлора, но их действие более продолжительно.
|
|
|
Избыток активного хлора, который остался в воде после его взаимодействия с органическими и неорганическими веществами, называют остаточным активным хлором.
Концентрация остаточного свободного хлора (в воде должна быть не менее 0,3 мг/л и не более 0,5 мг/л.
Избыточный активный хлор может быть удален путем дехлорирования, за счет обработки воды восстановителями (сульфит или тиосульфат натрия, сернистый газ, активированный уголь).
Взаимодействие хлора с гумусовыми и другими органическими веществами приводит к образованию широкой гаммы хлорорганических продуктов - тригалометанов, хлоралканов, хлорированных кислот и фенолов. Находящийся в воде фенол (ПДК=0,001 мг/л)прихлорировании превращается в более токсичный 2,4,6-трихлорфенол (ПДК=0,0004 мг/л), обладающий специфическим запахом.
Основное возражение против хлорирования связывают с возможностью образования вредных соединений - хлороформа СНС13 (ПДК=0,2 мг/л) и других тригалометанов (СНСl2Вг, СНС1Вг2, СНВг3). Замена хлора на гипохлорит натрия (без аммонизации!) увеличивает вероятность образования тригалометанов. Опытным путем установлено, что при концентрации остаточного активного хлора в интервале 0,3-1,1 мг/л и наличии в воде органики, содержание образующегося СНС13 не превышает 0,06 мг/л. Дальнейшее повышение концентрации остаточного активного хлора приводит к повышенному образованию хлороформа.
Самое простое техническое решение, приводящее к уменьшению содержания тригалометанов в питьевой воде, состоит в хлорировании воды только после ее осветления и фильтрования. Снижение содержания органических веществ в воде на стадии предварительной очистки до операции хлорирования - наиболее рациональный путь улучшения качества воды при ее обеззараживании.
Существенно уменьшить концентрацию тригалометанов, а также других вредных хлорорганических соединений в питьевой воде можно за счет использования вместо хлора хлораминов, образующихся при обработке гипохлоритом натрия воды, содержащей ионы аммония.
При взаимодействии хлораминов с органикой не происходит образования канцерогенных веществ. Хлорамины по сравнению с молекулярным хлором органолептически менее ощутимы, а при наличии в воде фенолов, они не образуют хлорфенольных запахов. Аммонизация осуществляется технически просто, а использование гипохлорита натрия также снимает все опасные и вредные производственные факторы, присущие самому хлору.
|
|
|
Хлорирование воды, содержащей органические вещества, в структурах которых имеются бензольные кольца (лигнин, гуминовые и фульвокислоты, фенолы и др.), может также приводить к образованию высокотоксичных диоксинов и родственных им хлорорганических соединений. Комплексный характер действия этой группы соединений приводит к генетическим изменениям, подавлению иммунитета, канцерогенезу, поражению внутренних органов и истощению человека. Максимальной токсичностью обладает 2,3,7,8-тетрахлордибензодиоксин, а также 2,3,7,8-тетрахлордибензофуран. Эти соединения имеют токсичность на много порядков выше, чем, например, широко известный препарат ДДТ (дуст).
Коварство токсического действия диоксинов заключается в том, что они незаметно накапливаются в организме, совершенно не проявляя себя, а затем наносят удар по иммунной системе. Их воздействие на организм сводится к тому, что молекула диоксина входит в рецептор и вписывается в структуру ДНК в строго определенных местах. Структура ДНК при этом не повреждается, но искривляется и становится более податливой воздействиям химических веществ. Сам диоксин не вызывает болезни, а лишь способствует развитию некоторых изних, например рака, при наличии канцерогенных веществ. Все обычно начинается с раздражения кожи, за которым появляется фурункулез, злокачественные опухоли, психические расстройства, рождение детей-уродов и т. П (Мешалкин, 2007).
Принцип метода основан на окислении йодида активным хлором до йода, который титруют тиосульфатом натрия.
Нитриты, окись железа, озон и другие соединения в кислом растворе выделяют йод из йодида калия, поэтому пробы воды необходимо подкислить буферным раствором с рН 4,5.
Экспериментальная часть
Оборудование и реактивы:
|
|
|
3. 0,1 н. раствор тиосульфата натрия: 25 г тиосульфата натрия (Nа2S203•5Н20) растворяют в свежепрокипяченной и охлажденной дистиллированной воде, добавляют 0,2 г карбоната натрия (Nа2СО3) и доводят до объема 1 л;
4. 0,01 н. раствор тиосульфата натрия: 100 мг 0,1 н. раствора тиосульфата натрия разбавляют дистиллированной водой, добавляют 0,2 г карбоната натрия и доводят до объема 1 л;
5. 0,005 н. раствор тиосульфата натрия: 50 мл 0,1 н. раствора тиосульфата натрия разбавляют дистиллированной водой, добавляют 0,2 г карбоната натрия и доводят до объема 1 л;
6. 0,01 н. раствор двухромовокислого калия: 0,4904 г перекристаллизованного двухромовокислого калия (К2Сr207), взвешенного с точностью до 0,0002 г, растворяют в 1 л дистиллированной воды;
7. 0,5% - раствор крахмала: 0,5 г крахмала смешивают с небольшим объемом дистиллированной воды, приливают к 100 мл кипящей дистиллированной воды и кипятят несколько минут. Консервирование проводят после охлаждения, добавляя хлороформ или 0,1 г салициловой кислоты;
8. буферный раствор рН 4,5:102 мл 1 молярной уксусной кислоты и 98 мл 1 молярного раствора уксуснокислого натрия вносят в колбу емкостью 1 л и доводят до метки дистиллированной водой.
9. колба коническая емкостью 500 мл;
10. пипетки
Определение поправочного коэффициента. В коническую колбу помещают 0,5 г йодида калия, растворяют в 2 мл дистиллированной воды, прибавляют 5 мл серной кислоты (1:4), затем 10 мл 0,01 н раствора К2Сr207, добавляют 80 мл дистиллированной воды, закрывают колбу пришлифованной пробкой, перемешивают и ставят в темное место на 5 мин.
Титрование проводят 0,01 н. раствором тиосульфата натрия в присутствии 1 мл крахмала, прибавленного в конце титрования.
Поправочный коэффициент (К) вычисляют по формуле:
К=10/а,
где а - количество тиосульфата натрия, израсходованное на титрование, в миллилитрах.
Ход работы:
0,5 г йодида калия помещают в коническую колбу и растворяют в 1 - 2 мл дистиллированной воды, затем добавляют буферный раствор в количестве, примерно равном полуторной величине щелочности исследуемой воды, после чего добавляют 250 мл исследуемой воды. Выделившийся йод оттитровывают 0,005 н. раствором тиосульфата натрия до появления светло-желтой окраски. Затем прибавляют 1 мл 0,5% раствора крахмала и титруют до исчезновения синей окраски.
Содержание суммарного остаточного хлора (X);в миллиграммах на литр вычисляют по формуле:
Х=а · К ·0,117·1000/ V,
где а - количество 0,005 н раствора тиосульфата натрия, израсходованное на титрование, в миллилитрах;
К - поправочный коэффициент нормального раствора тиосульфата натрия;
0,177 - количество хлора, соответствующее 1 мл 0,0005 н. раствора тиосульфата натрия;
|
|
|
V - объем исследуемой воды, в миллилитрах.
(Таубе, 1981)
Контрольные вопросы
1. Какие Вам известны обеззараживающие вещества при хлорировании?
2. Что называют остаточным активным хлором?
3. Каким образом можно удалить избыточный активный хлор?
4. Какие существуют недостатки у такого метода обеззараживания воды?
Лабораторная работа №2
Определение железа
Теоретическая часть
Подземные воды часто содержат повышенные концентрации железа, которое придает ей неприятный металлический привкус. Чаще всего железо в подземных водах содержится в истинно растворенном состоянии в виде бикарбоната железа Fе(НСО3)2. Такая вода после излива из скважины в первое время остается бесцветной и прозрачной, но при стоянии в открытом сосуде постепенно мутнеет за счет выделения осадка Fе(ОН)3, образующегося в результате гидролиза соли и одновременного окисления Fе2+ кислородом воздуха:

 4 Fе(НСО3)2 + O2 + H2O 4 Fе(ОН)3 + 8CO2
4 Fе(НСО3)2 + O2 + H2O 4 Fе(ОН)3 + 8CO2
В поверхностных водах железо может находиться в виде тонкодисперсной взвеси Fе(ОН)3 или в виде комплексных органических соединений. В первом случае оно хорошо удаляется при осветлении воды коагуляцией, во втором случае для разрушения органических комплексов требуются окислители более сильные, чем кислород. При подпитке водоносного горизонта водами болот или рек железо в подземных водах может также находиться в виде комплексных органических соединений. Во всех случаях повышение рН способствует более глубокому удалению железа, и в большинстве случаев оно может быть удалено известкованием.
Железо относится к жизненно необходимым элементам. Основные его функции в организме человека связаны с переносом кислорода и с участием десятков железосодержащих ферментов в окислительных процессах
При продолжительном поступлении в организм человека относительно высоких концентраций железа (ПДКхп= 0,3 мг/л) его избыток накапливается в печени в коллоидной форме оксида железа (гемосидерин), разрушающе действующего на ее клетки. Период полувыведения железа из организма человека достаточно длителен и составляет около 5,5 лет.
Вода с повышенным содержанием железа непригодна для ряда производств, так как ухудшает качество выпускаемой продукции (производство шелковых или хлопчатобумажных тканей, искусственных волокон, оргстекла и др.). В системах оборотного водоснабжения при подпитке свежей железосодержащей водой происходит окисление железа на градирнях или в брызгательных бассейнах с последующим его отложением на стенках труб и сооружений, что нарушает их нормальную работу и выводит из строя. В паровых котлах при их питании железосодержащей водой наблюдается быстрое образование железоокисных накипей. Отложение гидроксида железа (III) в катионообменных фильтрах вызывает значительное снижение их ионообменной емкости, а для успешной эксплуатации электродиализных установок требуется, чтобы содержание железа в воде не превышало сотых долей мг/л.
Промышленные методы обезжелезивания основаны на выделении железосодержащих осадков, в первую очередь Fе(ОН)3, и их последующем отделении фильтрованием. Многообразие методов обезжелезивания воды исключает их равноценность в отношении надежности, технологичности, экономической целесообразности, простоты, области применения и т. п. Обезжелезивание поверхностных вод возможно лишь реагентными методами (известкование, обработка коагулянтами), а для удаления железа из подземных вод наибольшее распространение получили безреагентные методы, в частности метод глубокой аэрации.

 Аэрация в совокупности с подщелачиванием является универсальным методом, который позволяет удалять железо во всех формах. В качестве щелочных агентов могут быть использованы известь или сода. Суммарные реакции для этих случаев могут быть описаны следующими уравнениями:
Аэрация в совокупности с подщелачиванием является универсальным методом, который позволяет удалять железо во всех формах. В качестве щелочных агентов могут быть использованы известь или сода. Суммарные реакции для этих случаев могут быть описаны следующими уравнениями:
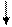
 4Fе(НСО3)2 + 8Са(ОН)2 + O2 4 Fе(ОН)3 +8СаСО3 + 6Н2О
4Fе(НСО3)2 + 8Са(ОН)2 + O2 4 Fе(ОН)3 +8СаСО3 + 6Н2О
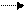 4Fе(НСО3)2 + 8Nа2СО3 + O2 + 10Н2O 4 Fе(ОН)3 + 16NаНСО3 (Мешалкин, 2007).
4Fе(НСО3)2 + 8Nа2СО3 + O2 + 10Н2O 4 Fе(ОН)3 + 16NаНСО3 (Мешалкин, 2007).
Принцип метода определения железа основан на взаимодействии окисного железа в сильно кислой среде с роданидом аммония, с образованием окрашенного в красный цвет соединения. Интенсивность окраски сравнивают со стандартным раствором железо-аммониевых квасцов.
Экспериментальная часть
Оборудование и реактивы:
1. Стандартный раствор железоаммониевых квасцов NНFе4•12Н20, содержащий в 1 мл 0,1 мг железа. Растворяют в мерной литровой колбе в небольшом количестве дистиллированной воды 0,8636 г перекристаллизованных железоаммониевых квасцов, добавляют несколько капель соляной кислоты (отн. плотность 1,19) до получения прозрачного раствора и доводят дистиллированной водой до метки.
2. Аммония роданид или калия, 50% раствор.
3. Аммония персульфат (NH4)2S2O8 в кристаллах.
4. Соляная кислота (отн. плотность 1,19), свободная от железа.
5. Колба мерная емкостью 1 л.
6. Пробирки.
7. Пипетки.
Ход работы:
|
|
|


