 |
Количественное определение общего содержания железа.
|
|
|
|
Объем исследуемой воды для определения берут, исходя из приближенного содержания, учитывая, что оптимальная концентрация для колориметрического определения железа в пределах 0,05 - 0,2 мг в пробе.
Воду взбалтывают, отбирают пипеткой необходимое количество и помещают в мерную колбу емкостью 100 мл, доводя, если требуется, объем дистиллированной водой до метки. Добавляют 2 мл концентрированной соляной кислоты, несколько кристаллов персульфата аммония и 2 мл роданида аммония или калия. Содержимое перемешивают стеклянной палочкой после добавления каждого реактива. Одновременно в таких же колбочках готовят 2 - 3 образцовых раствора, добавляя в них требуемое количество (в миллилитрах), стандартного раствора. В образцовые растворы вносят те же реактивы. Колориметрирование ведут в цилиндрах Генера на белом фоне.
Содержание железа в миллиграммах на литр вычисляют по формуле:
0,1· n · h ·1000
 Х =
Х =
h1 · V
где: - п— количество стандартного раствора взятого для приготовления образцового раствора, в миллилитрах;
h - высота столба в цилиндре Генера с образцовым раствором;
h1 - высота столба в цилиндре с испытуемой водой;
V— объем воды, взятой для определения, в миллилитрах.
При определении железа на фотоэлектроколориметре берут две мерные колбы емкостью 50 мл каждая, в первую колбу наливают пипеткой 46 мл исследуемой воды, во вторую—такое же количество дистиллированной воды. Затем в обе колбы вно сят по 5 мл соляной кислоты, 2—3 кристалла персульфата аммония, 1 мл раствора роданида аммония. Содержимое колбы с исследуемой водой доводят дистиллированной водой до метки. Во вторую колбу вносят из бюретки необходимое количество стандартного раствора, приближенного к ожидаемому содержанию его в исследуемой воде, исходя из качественного определения с приближенной количественной оценкой.
|
|
|
Определение оптической плотности проводят через 10 мин в кювете с толщиной слоя 20 мм при синем светофильтре.
Содержание железа в миллиграммах на литр вычисляют по формуле:
Сст·D1
 Х =
Х =
D2
где: Сст—концентрация железа в стандартном растворе в миллиграммах на литр;
D1 - оптическая плотность раствора;
D2 - оптическая плотность стандартного раствора.
Вычисление производят с точностью до 0,01 мг/л. Для построения калибровочной кривой в мерные колбы емкостью 50 мл вливают 0,5, 1, 2, 3, 4, 5 мл стандартного раствора железоаммониевых квасцов. В каждую колбу вносят по 0,5 мл соляной 'кис лоты, несколько кристаллов персульфата аммония, по 1 мл раствора роданита аммония и дистиллированной водой доводят объём до метки.
Значение концентрации железа откладывают по оси абсцисс, а оптическую плотность по оси ординат.
(Таубе, 1981)
Контрольные вопросы
1. Какими соединениями железо представлено в подземных и поверхностных водах?
2. Чем опасно избыточное содержание железа в оргнанизме человека?
3. Почему вода с повышенным содержанием железа непригодна для ряда производств?
4. Какие Вам известны методы удаления железа из подземных и поверностных вод?
Лабораторная работа №3
Определение окисляемости природных и сточных вод
Теоретическая часть
Природные воды почти всегда содержат то или иное количество органических веществ.
С санитарно-гигиенической точки зрения присутствующие в воде органические вещества делятся на две группы:
1) продукты биохимического распада растительных и животных остатков и обмена веществ, главным образом планктонного происхождения (автохтонные);
2) продукты разложения разнообразных отходов, попадающих в воду вместе со сточными водами (аллохтонные).
|
|
|
Основные источники обогащения поверхностных вод органическими веществами:
1) поступление с водосборной площади;
2) образование в самом водном объекте;
3) поступления из подземных водоносных горизонтов;
4) промышленные, хозяйственно-бытовые и сельскохозяйственные стоки.
Ввиду большого разнообразия органических соединений, которые могут содержаться в воде, индивидуальное определение каждого из них может оказаться очень сложным и во многих случаях это нецелесообразно. Наиболее распространенной характеристикой суммарного содержания органических веществ в воде является так называемая ²окисляемость².
²Окисляемость² - это количество кислорода в миллиграммах, расходуемое на окисление всех органических веществ, содержащихся в титре воды.
В зависимости от применяемого окислителя различают перманганатную окисляемость (окислитель KMnO4) и бихроматную окисляемость (окислитель K2Cr2O7). Во избежание ошибки предварительно в исследуемой воде определяют неорганические восстановители (Fe2+, SO32-, H2S). Затем к пробе воды приливают заведомо избыточное количество окислителя и проводят окисление. Определяют количество окислителя, которое осталось непрореагировавшим, и по разности рассчитывают окисляемость анализируемой воды.
Окисление перманганатом проводят в кислой (метод Кубеля) или в щелочной среде (метод Шульца) в зависимости от содержания хлорид-ионов в исследуемой воде. Окисление органических соединений перманганатом калия происходит неполно, поэтому его используют главным образом, как экспресс-метод качественной оценки природных вод.
Органические вещества окисляются более полно бихроматом калия, окисление бихроматом во всех случаях проводят в кислой среде. Этот способ используют для анализа сточных вод, определяя так называемое ХПК – химическое потребление кислорода. Полнота окисления в значительной степени зависит от концентрации серной кислоты. Условия, предписываемые арбитражным методом, позволяют найти значение ХПК близкое к теоретическому (табл.2). Теоретическим значениям ХПК называют количество мг кислорода необходимое для полного окисления 1 мг органического вещества. Расчёт производят, полагая, что углерод, сера, фосфор и другие элементы (кроме азота), присутствующие в органическом веществе, окисляются до СО2, Н2О, Р2О5, SO3 и соответствующих оксидов других элементов, а азот превращается в аммиак. Кислород входящий в состав окисляемых органических веществ, участвует в процессе окисления, а водород этих соединений при наличии азота расходуется на образование аммиака в соотношении N: Н = 3: 1. Например, окисление нитроанилина:
|
|
|
NO2C6H4NH2 + 100 → 6СО2 + 2NH3
моль нитроанилина = 138
10 моль – атомов кислорода = 16 . 10 = 160
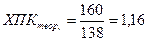 мг/мг.
мг/мг.
Таблица 2
Теоретические значения ХПК для некоторых органических веществ
| Вещество | ХПКтеор., мг/мг. | Вещество | ХПКтеор., мг/мг. |
| анилин | 2,41 | нафталин | 3,00 |
| ацетон | 2,21 | нафтол | 2,42 |
| ацетальдегид | 1,82 | нитробензол | 1,43 |
| бензол | 3,07 | пропиловый спирт | 2,40 |
| бутиловый спирт | 2,59 | резоцин | 1,89 |
| глицерин | 1,21 | октан | 3,51 |
| гептан | 3,52 | толуол | 3,13 |
| диэтиленгликоль | 1,51 | фенол | 2,38 |
| диэтаноламин | 1,52 | фенилендиамин | 1,92 |
| додецилбензолсульфонат | 2,34 | формальдегид | 1,07 |
| натрия (ПАВ) | этиловый спирт | 2,09 | |
| крезол | 2,52 | этаноламин | 1,31 |
| ксилол | 3,17 | этиленгликоль | 1,29 |
| кумол (изопропилбензол) | 3,20 | уксусная кислота | 1,07 |
| масляная кислота | 1,82 |
Экспериментальная часть
|
|
|


