 |
Животные (твердые) предельные . Исключение:рыбий жир
|
|
|
|
АЛКАНЫ
Общая характеристика
Углеводороды - простейшие органические соединения, состоящие из двух элементов: углерода и водорода. Предельными углеводородами, или алканами (международное название), называются соединения, состав которых выражается общей формулой С n Н2n+2, где n - число атомов углерода. В молекулах предельных углеводородов атомы углерода связаны между собой простой (одинарной) связью.
Окончание -ан является характерным для названий предельных углеводородов
Алканы, начиная с четвертого члена ряда (бутана), имеют изомеры.
Все алканы насыщены водородом до предела (максимально). Их атомы углерода находятся в состоянии sp 3 —гибридизации, а значит, имеют простые (одинарные) связи.
| Углеводороды | |||
| Метан | CH 4 | Гексан | C 6 H 14 |
| Этан | C 2 H 6 | Гептан | C 7 H 16 |
| Пропан | C 3 H 8 | Октан | C 8 H 18 |
| Бутан | C 4 H 10 | Нонан | C 9 H 20 |
| Пентан | C 5 H 12 | Декан | C 10 H 22 |
Получение. Свойства.
Свойства алканов: Нерастворяются в воде,а в органических в-вах растворяются.
Химич.св-ва
I.Реакции замещения атомов водорода:
1) гологенирование:
СН4+СI2 à CH3+HCI
2) Нитрование (реакция Коновалова). При действии разбавленной азотной кислоты на алканы при 140°С и небольшом давлении протекает реакция:
t °
CH3-CH3 + HNO3 → CH3-CH2-NO2 + H2O.(НИТРОЭТАН)
CH4+HNO3 → CH3-NO2+H2O(НИТРОМЕТАН)
3) Изомеризация. алканы могут превращаться в алканы с разветвленной цепью:
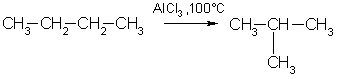
4) Разложения:
*полное:
t °
CH4 → C+ 2H2
t °
CH3-CH3 → 2C+3H2
*неполное (крекинг) Крекинг — это гемолитический разрыв связей С-С. При крекинге высших алканов образуются алкены и низшие алканы, при крекинге метана и этана образуются ацетилен:
t °
CH3 - CH2 - CH2 - CH3 → CH3-CH3(этан) +CH2=CH2 (этен)

5) р-ция окисления:
|
|
|
*полное окисление(горение)
СnН2n+2 + (Зn+1)/2О2 = nСО2 + (n+1)Н2О.
CH4+2O2=CO2+2H2O
*неполное окисление:
t °
CH3-CH2-CH2-CH3 + KMnO4 + H2SO4 → 2CH3-COOH(уксусная к-та)+K2SO4+MnSO4+H2O
Способы получения алканов:
I.в промышленности алканы получают переработкой природных источников С1-С10 -природный газ. С5-С10 нефть.
II. лабораторный способ получения алканов:
1) Действие металлического Na на моногалогеннопроизводные алканы.
Р-ция Вюрца:
С2Н5Br + 2Na + Br-C2H5 → C2H5-C2H5 + 2NaBr.
2) р-ция Кольбе- Электрохим. окисление карбоновых к-т или их солей
2CH3-COOK+H2O → 2CO2 + CH3-CH3+KOH+H2
3) РЕАКЦИИ С УМЕНЬШЕНИЕМ УГЛЕРОДНОЙ ЦЕПИ:
*СПЛАВЛЕНИЕ СОЛЕЙ КАРБОНОВЫХ К-Т С ЩЕЛОЧАМИ (СИНТЕЗ Дюма)
t °
CH3-COONa+ NaOH → NaCO3+CH4
III. специфические способы получения СН4
· Синтез из простых в-в:
С+2Н2=СН4
· Гидролиз карбида аллюминия (AI4C3)
AI4C3+ H2O → 4AI(OH)3+3CH4 ↑
Алкены
Алкены— ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации.
Простейшим алкеном является этен (C2H4). По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса на «-ен»;
I.Структурная изомерия
Структурные изомеры-отличаются друг от друга порядковым соединением атомов в молекуле.
1) изомерия углеродного скелета
2)изомерия положения кратной связи:
CH2=CH-CH2-CH3 -бутен-1
CH3-CH=CH-CH3- бутен-2
3) иежклассовая изомерия
4) изомерами алкенов являются циклоалканы
Физические свойства
Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи.
При нормальных условиях алкены с C2H4 до C4H8 — газы; с C5H10 до C17H34 — жидкости, после C18H36 — твёрдые тела. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Химические свойства
1) гидрирование
t °,Ni
CH2=CH-CH3+H2 → CH3-CH2-CH3
|
|
|
2) гологенирование:
Алкены обесцвечивают бромную воду-это кач.р-ция на двойную связь.
CH2=CH-CH3 +Br2 → CH2Br-CHBr-CH3 1,2 дибромпропан
3) гидрогологенирование:
CH2=CH-CH3+HBr → CH3-CH2Br-CH3
Присоединение идет по правилу Марковкина6 водород присоединяется к более гидрированному атому углерода (больше водорода)
4) Присоединение воды(гидротация)
Идет по правилу Марковника образуется спирты
CH2=CH-CH3 + HOH → CH3-CH OH-CH3 пропанол-2
5) реакции полимеризации
Полимеры-это высокомолекулярное соединение состоящее из многократно повторяющихся структурных молекул.
t °,Ni
n CH2=CH2 (этилен) → (-CH2-CH2-) n (полиэтилен)
р-ция окисления:
· Полное окисление (горение)
CH2=CH-CH3 + 8.5 O2 → 3CO2+3H2O
· Неполное окисление
Алкены в отличии от алканов обесцвечивают р-р KMnO4 кач.реакция на двойную связь. Продукты р-ции зависят от реакции среды.
а) в нейтральной среде алкены окисляются до двух атомных спиртов
CH2=CH-CH3+ KMnO4 +H2O → CH2OH-CHOH-CH3 + MnO2 (СТРЕЛКА ВНИЗ)+KOH
б) в кислой среде образуется смесь карбоновых к-т. р-я идет с разрывом углеродной цепи:
CH3-CH=CH-CH2-CH3+ KMnO4+H2SO4 →CH3-COOH+CH3-CH2-CH3+K2SO4+MnSO4+H2O
*если 2-ая связь находится у крайнего атома углерода,то концевой атом углерода окисляется до СО2
CH2=CH-CH3+ KMnO4+H2SO4→ СО2+ CH3-COOH+K2SO4+MnSO4+H2O
Получение алкенов
I. Крекинг алканов:

II. Отщепление двух атомов или групп атомов от соседних атомов углерода с образованием между ними p-связи.
- Дегидрогалогенирование моногалогеналканов при действии спиртового раствора щелочи
CH3-CH(Br)-CH3+KOH(спирт)→ CH3-CH=CH2+ KBr+H2O
- Дегидратация спиртов
при температуре менее 150°C в присутствии водоотнимающих реагентов
H2SO4
CH3-CH OH-CH3 → CH3-CH=CH+H2O
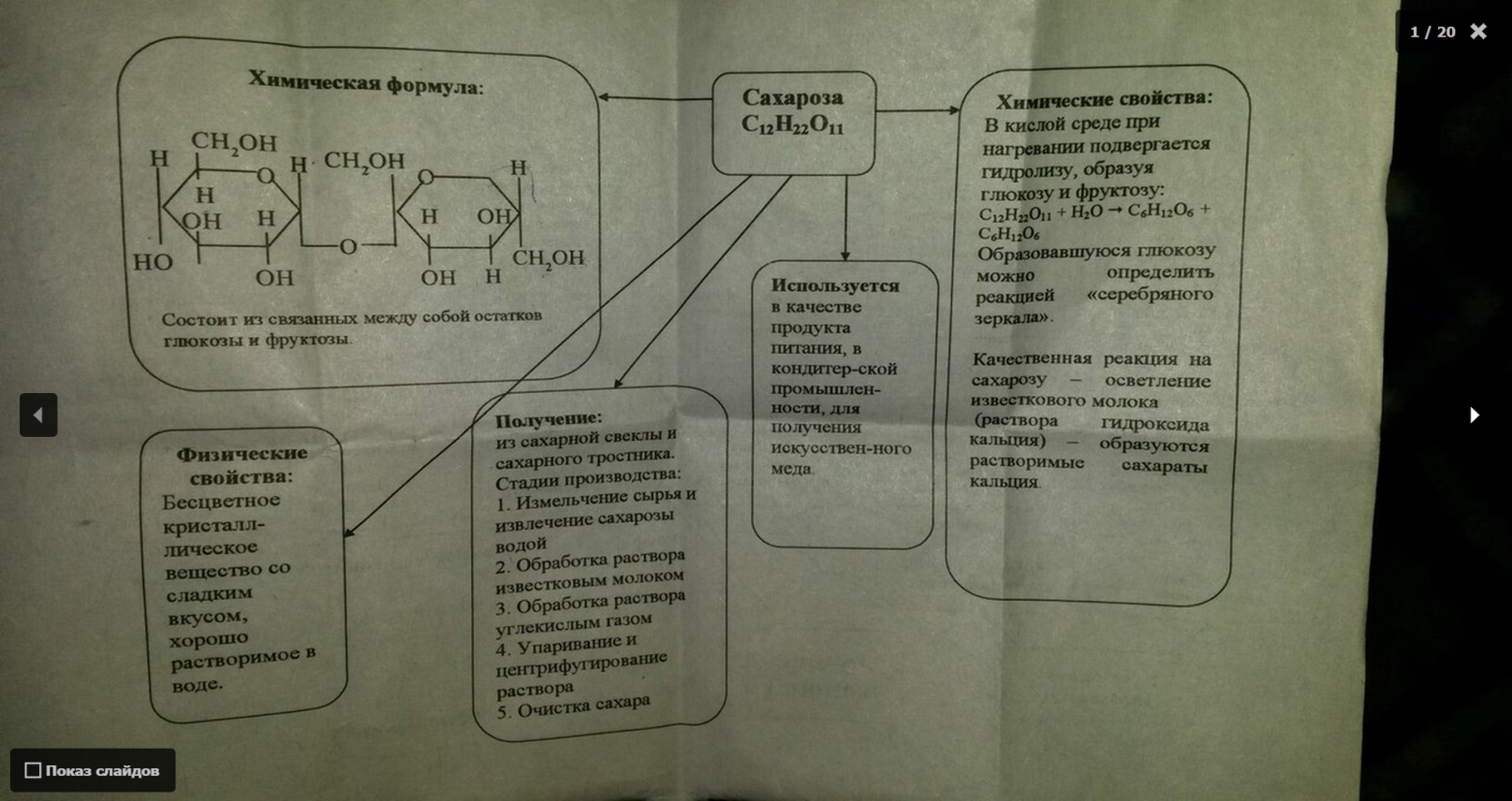
Дисахариды.
Жиры и масла.
Жиры-это сложные эфиры. 3х атомного спирта глицерина и высших карбоновых к-т.
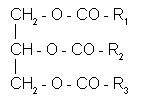
где R1, R2, R3 - радикалы жирных кислот.
Кислоты входящие в состав жиров:
1.предельные - стеариновая - C17H35COOH, пальмитиновая - C15H33COOH
2. непредельные C17H33COOH олеиновая к-та.
Классификация жиров.
ЖИРЫ:
ЖИВОТНЫЕ (ТВЕРДЫЕ) предельные. исключение:рыбий жир
|
|
|


