 |
Синтез из 1,4-дикарбонильных соединений по Паалю-Кнорру.
|
|
|
|
П ри нагревании 1,4—дикарбонильных соединений с такими нуклеофильными реагентами, как аммиак или сульфиды, образуются соответственно производные пиррола и тиофена. Нагревание 1,4—дикарбонильных соединений в присутствии кислотного катализатора дает производные фурана.

^ 2) Синтез пирролов по Кнорру.
Метод состоит в конденсации a-аминокетонов с b-дикарбонильными соединениями в присутствии кислотного или основного катализатора.

^ 3) Взаимные превращения (реакция Юрьева).

При нагревании (~4000С) над катализатором Al2O3 происходят превращения фурана, пиррола и тиофена друг в друга. Практическое значение имеют получение пиррола и тиофена из фурана.
^ Физические свойства и строение
Пиррол, фуран и тиофен – бесцветные жидкости с приятным запахом. Температура кипения пиррола (130-1310С) значительно превышает температуры кипения фурана (320С) и тиофена (840С), что обусловлено его ассоциацией за счет образования водородных связей.
Пиррол, фуран и тиофен могут быть отнесены к ароматическим соединениям, так как их молекулы содержат циклическую сопряженную систему, включающую 6 p-электронов. Они являются электронными аналогами ароматического карбоцикла – циклопентадиенил-аниона. В молекуле пиррола атом азота находится в состоянии sp2-гибридизации и образует три s-связи, лежащие в плоскости кольца. р-Орбиталь атома азота со свободной парой электронов взаимодействует с четырьмя р-орбиталями атомов углерода с образованием циклической p-системы, содержащей секстет p-электронов.

p-МО пиррола качественно похожи на орбитали циклопентадиенил-аниона. Возмущение, вызванное введением гетероатома, выражается в расщеплении уровней p2 и p3, которые в циклопентадиенил-анионе являются вырожденными (имеют одинаковую энергию). Более низкую энергию имеет орбиталь p2, которая имеет больший коэффициент на атоме азота. Такое расщепление уровней является отражением частичной локализации неподеленной пары электронов на атоме азота. Ниже приведена схема p-МО пиррола. Диаметр кружка пропорционален коэффициенту данной атомной орбитали в молекулярной орбитали, а наличие или отсутствие штриховки соответствует знаку волновой функции.
|
|
|

Атом азота в пирроле действует как электронодонор по мезомерному механизму, поэтому p-электронная плотность на атомах углерода пиррола повышена по сравнению с бензолом. Такие гетероциклы называют p -избыточными (на пять атомов приходится шесть p-электронов).
Гетероциклы фуран и тиофен имеют аналогичную p-систему, в которой одна из неподеленных пар электронов кислорода и серы соответственно участвуют в образовании ароматического секстета. Фуран и тиофен также относятся к p - избыточнымигетероциклическим соединениям.
Подтверждением ароматического характера пиррола, фурана и тиофена является их плоское строение и длины связей, которые имеют промежуточные значения между обычными простыми и двойными связями С-С, C-N, C-O и C-S. Эмпирические оценки и квантово-механические расчеты показывают, что пятичленные гетероциклы стабилизированы за счет делокализации p-электронов, однако энергия делокализации у них ниже, чем у бензола. В наименьшей степени стабилизирован фуран, который, таким образом, обладает меньшей ароматичностью, чем пиррол и тиофен.
Молекулы пиррола, фурана и тиофена полярны. У пиррола дипольный момент направлен от атома азота на цикл. У фурана и тиофена отрицательный конец диполя, напротив, находится на гетероатоме.

| m=1,75D | m=1,95D |
Пиррол, фуран и тиофен являются электронодонорными соединениями с энергиями ионизации соответственно 8,2; 8,9 и 9,0 эВ, что ниже, чем у бензола (9,24 эВ).
|
|
|
^ Химические свойства
1) Основные свойства
Пиррол является чрезвычайно слабым основанием. Протонирование по атому азота означает нарушение стабильной p-системы и потерю ароматичности. В действительности присоединение протона происходит по атомам углерода пиррольного кольца, преимущественно по a-положению. Образующаяся таким образом сопряженная кислота атакует молекулу пиррола, в результате чего происходит полимеризация.

Фуран также полимеризуется под действием кислот. Поэтому пиррол и фуран называют ацидофобными соединениями. Введение электроноакцепторных групп снижает ацидофобность. Например, фурфурол и пирослизевая кислота устойчивы к действию кислот.
Тиофен, в отличие от пиррола и фурана, неацидофобен.
2) Кислотные свойства пиррола
Пиррол является слабой NH-кислотой (рКа=17,5). По кислотности он превосходит амины и близок к спиртам. Соли пиррола получают взаимодействием пиррола с металлами, амидами металлов, металлоорганическим соединениями.

^ 3) Реакции электрофильного замещения
Пиррол, фуран и тиофен являются электронодонорными соединениями и проявляют высокую реакционную способность по отношению к электрофилам. Реакционная способность в реакциях электрофильного замещения возрастает в ряду бензол<тиофен<фуран<пиррол.
Электрофильное замещение идет преимущественно в положение 2, что вытекает из сравнения стабильности s-коплексов, ведущих к продуктам 2- и 3-замещения.

Как видно из приведенной выше для пиррола схемы, в s-комплексе, образующемся при атаке по положению 2, достигается более эффективная делокализации положительного заряда (три резонансные структуры), чем в s-коплексе, образующемся при атаке по положению 3 (две резонансные структуры).
Взаимодействие гетероциклов с электрофилами может привести и к образованию продуктов присоединения (см. кислотные свойства). Склонность к такого рода превращениям убывает в ряду фуран>пиррол>тиофен, что соответствует степени стабилизации их ароматических систем.
Пиррол по реакционной способности по отношению к электрофилам напоминает активированные ароматические субстраты (фенол или ароматические амины). Из-за ацидифобности пиррола при проведении реакций электрофильного замещения необходимо избегать сильно кислых сред. Основные SE-реакции пиррола суммированы на схеме.
|
|
|

Нитрование и сульфирование пиррола возможны только в том случае, если исключена сильнокислая среда. Нитрование проводят действием ацетилнитрата при низких температурах. Для сульфирование используют связанный в комплекс SO3, например, пиридинсульфотриоксид. Галогенирование протекает без катализатора и дает тетрагалогенпирролы. Пиррол ацилируется ангидридами кислот в отсутствие катализатора. Как активированный субстрат пиррол вступает в реакции формилирования. Наиболее общим методом формилирования пирролов является реакция Вильсмейера-Хаака.
Фуран, как и пиррол, ацидофобен, поэтому реакции с электрофилами проводят в отсутствие сильных кислот. Фуранацилируется ангидридами кислот в присутствии мягких кислот Льюиса, сульфируется пиридинсульфотриоксидом, формилируется по реакции Вильсмейера-Хаака. Фуран реагирует более селективно, чем пиррол. Во всех случаях образуются исключительно продукты замещения по положению 2.

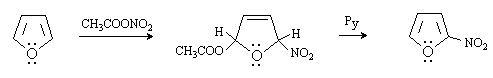
Фуран в большей степени, чем пиррол, склонен к образованию с электрофилами продуктов не замещения, а присоединения. Даже реакции, результатом которых является замещение, могут происходить через промежуточное образование продуктов присоединения (по механизму присоединения-отщепления). При нитровании фурана ацетилнитратом можно выделить продукт 2,5-присоединения, который под действием пиридина (Py), подвергается элиминированию с образованием в конечном итоге продукта замещения.
Тиофен, в отличие от пиррола и фурана, неацидофобен, поэтому реакции электрофильного замещения можно проводить с обычными электрофильными агентами, в том числе с использованием водных растворов минеральных кислот или в присутствии кислот Льюиса. Реакции электрофильного замещения превалируют над процессами присоединения.

Реакции присоединения
Гидрирование
Пиррол, фуран и тиофен присоединяют водород в условиях каталитического гидрирования с образованием тетрагидропроизводных.
|
|
|

Труднее других гидрируется тиофен, который отравляет катализатор. Особенностью химии тиофена является восстановительная десульфуризация, которая используется в синтетических целях для получения соединений, трудно доступных другими методами.

^ Реакция Дильса-Альдера
Реакции циклоприсоединения характерны для фурана, который в большей степени, чем пиррол и тиофен, проявляет свойства сопряженного диена. Например, он вступает при комнатной температуре в реакцию диенового синтеза с таким активным диенофилом, как малеиновый ангидрид.
 Шестичленные ароматические гетероциклы с одним гетероатомом
Шестичленные ароматические гетероциклы с одним гетероатомом
|
|
|


