 |
Обвмадеойс ъб ьлъпгйфпъпн й ьодпгйфпъпн ч цйчщи лмефлби
|
|
|
|
бОБМПЗЙЮОЩЕ ЬЛУРЕТЙНЕОФЩ ВЩМЙ РТПЧЕДЕОЩ У ЙУРПМШЪПЧБОЙЕ ЧЩУПЛП ЖМХПТЕУГЕОФОЩИ НЕФПЛ ДМС НБТЛЙТПЧЛЙ ТЕГЙЛМЙТПЧБООЩИ ЧЕЪЙЛХМ83). чОЕДТЕООБС вЕФГПН Й ЛПММЕЗБНЙ, ЬФБ НЕФПДЙЛБ ДБЕФ ФП ЧБЦОПЕ РТЕЙНХЭЕУФЧП, ЮФП ЛТХЗППВПТПФ ЧЕЪЙЛХМ НПЦОП ОБВМАДБФШ Ч ЦЙЧПН РТЕРБТБФЕ РП ЧЩЪЩЧБЕНЩН УФЙНХ-
236љљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљ тБЪДЕМ р. рЕТЕДБЮБ ЙОЖПТНБГЙЙ Ч ОЕТЧОПК УЙУФЕНЕ

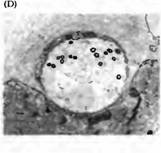  Fig. 11.21. Recycling of Specific Synaptic Vesicle Membrane Proteins. (A-C) Fluorescence micrographs of frog neuromuscular junctions labeled with antibodies to synaptophysin (a vesicle membrane protein) and fluorescein-conjugated second antibodies. (D, E) Electron micrographs of cross sections of neuromuscular junctions. (A) Normal junction. The axon terminal membrane must be made permeable with detergent in order for antibodies to reach synaptophysin. (B, D) Muscle was treated with a-latrotoxin, which causes quanta! transmitter release in the absence of calcium. This was done in calcium-free medium, which blocks endocytosis. Under these conditions, axon terminals are depleted of synaptic vesicles, appear distended, and stain without being made permeable. This indicates that synaptic vesicles have fused with the terminal membrane during exocytosis while retrieval of vesicle membrane was blocked, leaving synaptophysin exposed on the surface. (C, E) Muscle was treated with o-latrotoxin in normal saline. Terminals have a normal appearance and can be stained only after being made permeable. Under these conditions the vesicle population is maintained by active recycling while more than two times the initial store of quanta is released. Thus, despite the active turnover of synaptic vesicles, no detectable synaptophysin remains on the terminal surface, demonstrating the specificity and efficiency of synaptic vesicle membrane retrieval. (From Valtorta et al., 1988; micrographs kindly provided by F. Valtorta.)
Fig. 11.21. Recycling of Specific Synaptic Vesicle Membrane Proteins. (A-C) Fluorescence micrographs of frog neuromuscular junctions labeled with antibodies to synaptophysin (a vesicle membrane protein) and fluorescein-conjugated second antibodies. (D, E) Electron micrographs of cross sections of neuromuscular junctions. (A) Normal junction. The axon terminal membrane must be made permeable with detergent in order for antibodies to reach synaptophysin. (B, D) Muscle was treated with a-latrotoxin, which causes quanta! transmitter release in the absence of calcium. This was done in calcium-free medium, which blocks endocytosis. Under these conditions, axon terminals are depleted of synaptic vesicles, appear distended, and stain without being made permeable. This indicates that synaptic vesicles have fused with the terminal membrane during exocytosis while retrieval of vesicle membrane was blocked, leaving synaptophysin exposed on the surface. (C, E) Muscle was treated with o-latrotoxin in normal saline. Terminals have a normal appearance and can be stained only after being made permeable. Under these conditions the vesicle population is maintained by active recycling while more than two times the initial store of quanta is released. Thus, despite the active turnover of synaptic vesicles, no detectable synaptophysin remains on the terminal surface, demonstrating the specificity and efficiency of synaptic vesicle membrane retrieval. (From Valtorta et al., 1988; micrographs kindly provided by F. Valtorta.)
| тЙУ. 11.21. чФПТЙЮОПЕ ЙУРПМШЪПЧБОЙЕ УРЕГЙЖЙЮЕУЛЙИ ВЕМЛПЧ НЕНВТБОЩ УЙОБРФЙЮЕУЛЙИ ЧЕЪЙЛХМ. (б-у) жМХПТЕУГЕОФОЩЕ НЙЛТПЗТБЖЙЙ ОЕТЧОП-НЩЫЕЮОЩИ УПЕДЙОЕОЙК МСЗХЫЛЙ, ПЛТБЫЕООЩИ БОФЙФЕМБНЙ Л УЙОБРФПЖЙЪЙОХ (ВЕМПЛ ЧЕЪЙЛХМСТОПК НЕНВТБОЩ) Й ЧФПТЙЮОЩНЙ БОФЙФЕМБНЙ, ЛПОЯАЗЙТПЧБООЩНЙ У ЖМАПТЕУГЕЙОПН. (п, е) ьМЕЛФТПООЩЕ НЙЛТПЖПФПЗТБЖЙЙ РПРЕТЕЮОЩИ УТЕЪПЧ ОЕТЧОП-НЩЫЕЮОЩИ УПЕДЙОЕОЙК. (б) оЕТЧОП-НЩЫЕЮОПЕ УПЕДЙОЕОЙЕ Ч ЛПОФТПМЕ. нЕНВТБОБ БЛУПООПЗП ПЛПОЮБОЙС ДПМЦОБ ВЩФШ ПВТБВПФБОБ ДЕФЕТЗЕОФПН, ЮФПВЩ УФБФШ РТПОЙГБЕНПК ДМС БОФЙФЕМ, УЧСЪЩЧБАЭЙИУС У УЙОБРФПЖЙЪЙОПН. (ч, D) нЩЫГБ ВЩМБ ПВТБВПФБОБ a-МБФТПФПЛУЙОПН, ЛПФПТЩК УРПУПВЕО ЧЩЪЧБФШ ЧЩУЧПВПЦДЕОЙЕ НЕДЙБФПТБ Ч ПФУХФУФЧЙЙ ЛБМШГЙС. рПУМЕДХАЭЙК ЪОДПГЙФПЪ ВЩМ РТЕДПФЧТБЭЕО РХФЕН ХВЙТБОЙС ЛБМШГЙС ЙЪ ОБТХЦОПЗП ТБУФЧПТБ. ч ЬФЙИ ХУМПЧЙСИ ЪБРБУ УЙОБРФЙЮЕУЛЙИ ЧЕЪЙЛХМ Ч БЛУПООЩИ ПЛПОЮБОЙСИ ЙУФПЭБЕФУС, ПЛПОЮБОЙС ТБЪДХЧБАФУС Й ЙИ НПЦОП ПЛТБУЙФШ ДБЦЕ ВЕЪ РТЕДЧБТЙФЕМШОПК ПВТБВПФЛЙ ДЕФЕТЗЕОФПН. ьФП ХЛБЪЩЧБЕФ ОБ ФП, ЮФП УЙОБРФЙЮЕУЛЙЕ ЧЕЪЙЛХМЩ УМЙЧБАФУС У НЕНВТБОПК Ч РТПГЕУУЕ ЬЛЪПГЙФПЪБ, ЮФП Ч ХУМПЧЙСИ ЪБВМПЛЙТПЧБООПЗП ПВТБФОПЗП ЪБИЧБФБ ЧЕЪЙЛХМСТОПК НЕНВТБОЩ РТЙЧПДЙФ Л ДМЙФЕМШОПНХ ОБИПЦДЕОЙА УЙОБРФПЖЙЪЙОБ ОБ РПЧЕТИОПУФЙ ЛМЕФЛЙ. (у, е) нЩЫГБ ВЩМБ ПВТБВПФБОБ a-МБФТПФПЛУЙОПН Ч ОПТНБМШОПН ТБУФЧПТЕ. пЛПОЮБОЙС ЧЩЗМСДСФ ОПТНБМШОП Й НПЗХФ ВЩФШ ПЛТБЫЕОЩ ФПМШЛП РПУМЕ ПВТБВПФЛЙ ДЕФЕТЗЕОФПН. ч ЬФЙИ ХУМПЧЙСИ РПРХМСГЙС ЧЕЪЙЛХМ РПДДЕТЦЙЧБЕФУС БЛФЙЧОЩН ТЕГЙЛМЙТПЧБОЙЕН, Ч ФП ЧТЕНС ЛБЛ ЙЪ ПЛПОЮБОЙС ЧЩУЧПВПЦДБЕФУС Ч ДЧБ ТБЪБ ВПМШЫЕ ЛЧБОФПЧ, ЮЕН ЙИ ВЩМП Ч УБНПН ОБЮБМЕ. ч ТЕЪХМШФБФЕ, ОЕУНПФТС ОБ БЛФЙЧОПЕ ЙУРПМШЪПЧБОЙЕ УЙОБРФЙЮЕУЛЙИ ЧЕЪЙЛХМ, ОБ РПЧЕТИОПУФЙ ПЛПОЮБОЙС ОЕ ПВОБТХЦЙЧБЕФУС УМЕДПЧ УЙОБРФПЖЙЪЙОБ, ЮФП ДЕНПОУФТЙТХЕФ УРЕГЙЖЙЮОПУФШ Й ЬЖЖЕЛФЙЧОПУФШ НЕИБОЙЪНБ ПВТБФОПЗП ЪБИЧБФБ ЧЕЪЙЛХМСТОПК НЕНВТБОЩ. |
МСГЙЕК ОБЛПРМЕОЙА Й ЧЩУЧПВПЦДЕОЙА НЕФЛЙ (ТЙУ. 11.23). ьФЙ ЙУУМЕДПЧБОЙС РПЪЧПМЙМЙ ПВОБТХЦЙФШ, ЮФП Ч ОПТНБМШОЩИ ЖЙЪЙПМПЗЙЮЕУЛЙИ ХУМПЧЙСИ РПМОЩК ГЙЛМ ЬЛЪПГЙФПЪБ ПВТБФОПЗП ЪБИЧБФБ Й ЖПТНЙТПЧБОЙС ОПЧЩИ УЙОБРФЙЮЕУЛЙИ ЧЕЪЙЛХМ ЪБОЙНБЕФ НЕОЕЕ 1 НЙОХФЩ 84) -- 86); ЧПУУФБОПЧМЕОЙЕ ЦЕ РПУМЕ ВПМЕЕ ЙОФЕОУЙЧОПК УФЙНХМСГЙЙ РТПЙУИПДЙФ НЕДМЕООЕЕ 79). вПМЕЕ
|
|
|
зМБЧБ 11. чЩУЧПВПЦДЕОЙЕ НЕДЙБФПТБљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљ 237
| тЙУ. 11.22. рТЕДРПМБЗБЕНЩЕ РХФЙ НЕНВТБООПЗП ЪБИЧБФБ Ч РТПГЕУУЕ ЧФПТЙЮОПЗП ЙУРПМШЪПЧБОЙС ЧЕЪЙЛХМ. рПУМЕ ЬЛЪПГЙФПЪБ ЧЕЪЙЛХМЩ, РПЛТЩФЩЕ ЛМБФТЙОПН, УЕМЕЛФЙЧОП ЪБИЧБФЩЧБАФ ЛПНРПОЕОФЩ ЧЕЪЙЛХМСТОПК НЕНВТБОЩ. оПЧЩЕ УЙОБРФЙЮЕУЛЙЕ ЧЕЪЙЛХМЩ ПВТБЪХАФУС ЙЪ РПЛТЩФЩИ ЧЕЪЙЛХМ МЙВП ОБРТСНХА, МЙВП ЮЕТЕЪ ЬОДПУПНЩ. рПУМЕ ЙОФЕОУЙЧОПК УФЙНХМСГЙЙ ОБВМАДБЕФУС ЪБИЧБФ ЙЪ ОЕРПЛТЩФЩИ ХЗМХВМЕОЙК Ч НЕНВТБОЕ, Б ФБЛЦЕ ЙЪ ГЙУФЕТО. оПЧЩЕ УЙОБРФЙЮЕУЛЙЕ ЧЕЪЙЛХМЩ, ПВТБЪПЧБЧЫЙЕУС ЙЪ ТЕГЙЛМЙТПЧБОЙЕН НЕНВТБОЩ, ЪБРПМОСАФУС ОЕКТПНЕДЙБФПТПН Й НПЗХФ ВЩФШ ЧЩУЧПВПЦДЕОЩ РТЙ УФЙНХМСГЙЙ. |  Fig. 11.22. Proposed Pathways for Membrane Retrieval during vesicle recycling. After exocytosis, clathrin-coated vesicles selectively recapture synaptic vesicle membrane components. New synaptic vesicles are formed from coated vesicles, either directly or through endosomes. After intense stimulation, retrieval occurs from uncoated pits and cisternae. The new synaptic vesicles formed from recycled membrane are filled with transmitter and can be released by stimulation.
Fig. 11.22. Proposed Pathways for Membrane Retrieval during vesicle recycling. After exocytosis, clathrin-coated vesicles selectively recapture synaptic vesicle membrane components. New synaptic vesicles are formed from coated vesicles, either directly or through endosomes. After intense stimulation, retrieval occurs from uncoated pits and cisternae. The new synaptic vesicles formed from recycled membrane are filled with transmitter and can be released by stimulation.
|
| тЙУ. 11.23. чЩЪЩЧБЕНЩЕ БЛФЙЧОПУФША ЪБИЧБФ Й ЧЩУЧПВПЦДЕОЙЕ ЖМХПТЕУГЕОФОПК НЕФЛЙ Ч БЛУПООЩИ ПЛПОЮБОЙСИ ОЕТЧОП-НЩЫЕЮОПЗП УПЕДЙОЕОЙС МСЗХЫЛЙ. жМХПТЕУГЕОФОЩЕ НЙЛТПЗТБЖЙЙ БЛУПООЩИ ПЛПОЮБОЙК Ч ЛПЦОП ЗТХДЙО ОПК НЩЫГЕ. (б) нЩЫГБ ВЩМБ ПВТБВПФБОБ ЖМХПТЕУГЕОФОПК НЕФЛПК (FM 1-43, У ЛПОГЕОФТБГЙЕК 2 НЛНПМШ) Ч ФЕЮЕОЙЕ 5 НЙОХФ Й ЪБФЕН ПФНЩЧБМБУШ ОБ РТПФСЦЕОЙЙ 30 НЙОХФ. мЙЫШ ОЕВПМШЫПЕ ЛПМЙЮЕУФЧП НЕФЛЙ ПУФБЕФУС УЧСЪБООПК У НЕНВТБОПК ПЛПОЮБОЙС. (ч) фБ ЦЕ НЩЫГБ ВЩМБ ДБМЕЕ ПВТБВПФБОБ НЕФЛПК Ч ФЕЮЕОЙЕ 5 НЙОХФ, Ч ФП ЧТЕНС ЛБЛ ОЕТЧ УФЙНХМЙТПЧБМУС У ЮБУФПФПК 10 Зг, Й ЪБФЕН ПФНЩЧБМБУШ ОБ РТПФСЦЕОЙЙ 30 НЙОХФ. жМХПТЕУГЕОФОЩЕ РСФОБ СЧМСАФУС ЛМБУФЕТБНЙ УЙОБРФЙЮЕУЛЙИ ЧЕЪЙЛХМ, ЛПФПТЩЕ ВЩМЙ ЪБРПМОЕОЩ НЕФЛПК Ч РТПГЕУУЕ ТЕГЙЛМЙТПЧБОЙС. (у) фБ ЦЕ НЩЫГБ ЪБФЕН УФЙНХМЙТПЧБМБУШ 5 НЙОХФ У ЮБУФПФПК 10 зГ Й ЪБФЕН ПФНЩЧБМБУШ Ч ФЕЮЕОЙЕ 30 НЙОХФ. Fig. 11.23. Activity-Dependent Uptake and Release of fluorescent dye by |  axon terminals at the frog neuromuscular junction. Fluorescence micrographs of axon terminals in a cutaneous pectoris muscle. (A) Muscle was bathed for 5 min in fluorescent dye (2 μΜ FM1-43) and washed for 30 min. Only small amounts of dye remain associated with the terminal membrane. (B) The same muscle was then bathed in dye for 5 min while the nerve was stimulated (10 Hz) and washed for 30 min. The fluorescent patches are clusters of synaptic vesicles that were filled with dye during recycling. (C) The same muscle was then stimulated at 10 Hz for 5 min and washed for 30 min. Stimulation released most of the dye. (Micrographs kindly provided by W. J. Betz.)
axon terminals at the frog neuromuscular junction. Fluorescence micrographs of axon terminals in a cutaneous pectoris muscle. (A) Muscle was bathed for 5 min in fluorescent dye (2 μΜ FM1-43) and washed for 30 min. Only small amounts of dye remain associated with the terminal membrane. (B) The same muscle was then bathed in dye for 5 min while the nerve was stimulated (10 Hz) and washed for 30 min. The fluorescent patches are clusters of synaptic vesicles that were filled with dye during recycling. (C) The same muscle was then stimulated at 10 Hz for 5 min and washed for 30 min. Stimulation released most of the dye. (Micrographs kindly provided by W. J. Betz.)
|
ФПЗП, ВЩМП РПЛБЪБОП, ЮФП ЪБИЧБФ ЖМХПТЕУГЕОФОЩИ НЕФПЛ Ч РТЕУЙОБРФЙЮЕУЛЙЕ ВХФПОЩ ЛХМШФЙЧЙТХЕНЩИ ЗЙРРПЛБНРБМЯОЩИ ОЕКТПОПЧ РТПЙУИПДЙФ ЛЧБОФПЧЩН ПВТБЪПН, РТЙЮЕН ТБЪНЕТ ЛБЦДПЗП ЛЧБОФБ УППФЧЕФУФЧХЕФ ЪБИЧБФХ ПДОПК УЙОБРФЙЮЕУЛПК ЧЕЪЙЛХМЩ87). фБЛПЗП ТПДБ ЛЧБОФПЧЩК ЪБИЧБФ РТПЙУИПДЙФ Ч ФЕЮЕОЙЕ УЕЛХОД РПУМЕ ОБЮБМБ УФЙНХМСГЙЙ, РТЕДРПМБЗБС.
|
|
|
238љљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљ тБЪДЕМ II. рЕТЕДБЮБ ЙОЖПТНБГЙЙ Ч ОЕТЧОПК УЙУФЕНЕ
|
|
|
| тЙУ. 11.24. чЩУЧПВПЦДЕОЙЕ НЕДЙБФПТБ Й ЪБИЧБФ ЧЕЪЙЛХМСТОПК НЕНВТБОЩ, ТЕЗЙУФТЙТХЕНЩК РП ЙЪНЕОЕОЙА НЕНВТБООПК ЕНЛПУФЙ. хЧЕМЙЮЕОЙЕ ЕНЛПУФЙ ЛМЕФЛЙ РТЙ ТЕЗЙУФТБГЙЙ РЬФЮ-ЬМЕЛФТПДПН Ч ЛПОЖЙЗХТБГЙЙ ПФ ГЕМПК ЛМЕФЛЙ ЙНЕЕФ УФХРЕОЮБФЩК ИБТБЛФЕТ, ПФТБЦБС УМЙСОЙЕ ПФДЕМШОЩИ ЧЕЪЙЛХМ У РМБЪНБФЙЮЕУЛПК НЕНВТБОПК. хНЕОШЫЕОЙЕ ЕНЛПУФЙ РТПЙУИПДЙФ РТЙ ПВТБФОПН ЪБИЧБФЕ ЧЕЪЙЛХМ. Fig. 11.24. Release and Retrieval of Vesicle Membrane monitored by changes in membrane capacitance. |  Increases in celt capacitance measured with the whole-cell patch pipette recording technique occur in a stepwise fashion reflecting the fusion of individual vesicles with the plasma membrane. Corresponding decreases in capacitance are seen during vesicle retrieval. The recordings are from a rat mast cell, which has particularly large secretory vesicles (800 nm in diameter). (After Fernandez, Neher, and Gomperts, 1984.)
Increases in celt capacitance measured with the whole-cell patch pipette recording technique occur in a stepwise fashion reflecting the fusion of individual vesicles with the plasma membrane. Corresponding decreases in capacitance are seen during vesicle retrieval. The recordings are from a rat mast cell, which has particularly large secretory vesicles (800 nm in diameter). (After Fernandez, Neher, and Gomperts, 1984.)
|
ЮФП ПДЙОПЮОЩЕ УПВЩФЙС ЬЛЪПГЙФПЪБ Й ЬОДПГЙФПЪБ ПЮЕОШ ВМЙЪЛП УЧСЪБОЩ. ьФБ НЕФПДЙЛБ РПЪЧПМСЕФ БОБМЙЪЙТПЧБФШ ЛЧБОФПЧПЕ ЧЩУЧПВПЦДЕОЙЕ ЙЪ ПФДЕМШОЩИ РТЕУЙОБРФЙЮЕУЛЙИ ВХФПОПЧ ВЕЪ ТЕЗЙУФТБГЙЙ РПУФУЙОБРФЙЮЕУЛЙИ ПФЧЕФПЧ. рПУЛПМШЛХ ТЕЗЙУФТЙТХАЭЙЕ ЬМЕЛФТПДЩ ОЕ ОХЦОЩ, ЬФЙ ПРФЙЮЕУЛЙЕ НЕФПДЩ ПЛБЪЩЧБАФУС ЧЕУШНБ ХДПВОЩНЙ РТЙ ЙУУМЕДПЧБОЙЙ РТЕУЙОБРФЙЮЕУЛПК ЖХОЛГЙЙ Й ДПМЗПЧТЕНЕООПК РМБУФЙЮОПУФЙ.
нОПЗППВЕЭБАЭЙН РПДИПДПН ДМС ЙУУМЕДПЧБОЙК ЬЛЪПГЙФПЪБ ЧЕЪЙЛХМ СЧМСЕФУС ЙУРПМШЪПЧБОЙЕ ОЕ ОЕКТПОБМШОЩИ УЕЛТЕФПТОЩИ ЛМЕФПЛ, ОБРТЙНЕТ, ЛМЕФПЛ НПМПЮОПК ЦЕМЕЪЩ Й ИТПНБЖЖЙООЩИ ЛМЕФПЛ, Ч ЛПФПТЩИ ЬЛЪПГЙФПЪ ВПМШЫЙИ Й РМПФОЩИ УЕЛТЕФПТОЩИ ЗТБОХМ НПЦЕФ ВЩФШ ЙУУМЕДПЧБО ПДОПЧТЕНЕООП У РПНПЭША УЧЕФПЧПК НЙЛТПУЛПРЙЙ, ЬМЕЛФТПЖЙЪЙПМПЗЙЮЕУЛПК ТЕЗЙУФТБГЙЙ Й БНРЕТПНЕФТЙЙ, ЛПФПТБС РПЪЧПМСЕФ ДЕФЕЛФЙТПЧБФШ БНЙОЩ, ЧЩДЕМСЕНЩЕ ЬФЙНЙ ЛМЕФЛБНЙ88ћ89'. уМЙСОЙЕ ПДЙОПЮОЩИ ЗТБОХМ У РМБЪНБФЙЮЕУЛПК НЕНВТБОПК НПЦЕФ ВЩФШ ЪБТЕЗЙУФТЙТПЧБОП РЬФЮ-ЬМЕЛФТПДПН Ч ЧЙДЕ ХЧЕМЙЮЕОЙС ЬМЕЛФТЙЮЕУЛПК ЕНЛПУФЙ ЛМЕФЛЙ, ЛПФПТПЕ ЧПЪОЙЛБЕФ РТЙ ДПВБЧМЕОЙЙ НЕНВТБООЩИ ЗТБОХМ Л ЛМЕФПЮОПК РПЧЕТИОПУФЙ; ПВТБФОЩК ЦЕ ЪБИЧБФ НЕНВТБОЩ РТЙ ЬОДПГЙФПЪЕ РТЙЧПДЙФ Л ХНЕОШЫЕОЙА ЕНЛПУФЙ (ТЙУ. 11.24)90). бМНЕТУ У УПБЧФПТБНЙ Ч ЬЛУРЕТЙНЕОФБИ ОБ ИТПНБЖЖЙООЩИ ЛМЕФЛБИ ДПВБЧЙМЙ ЬМЕЛФТПД ЙЪ ХЗПМШОПЗП ЧПМПЛОБ ЧОХФТШ РЬФЮ-ЬМЕЛФТПДБ, ЮФПВЩ ЙЪНЕТЙФШ ЧЩУЧПВПЦДЕОЙЕ ЛБФЕИПМБНЙОПЧ, УПДЕТЦБЭЙИУС Ч ЗТБОХМБИ91'. чЩУЧПВПЦДЕОЙЕ ПВЩЮОП ДЕФЕЛФЙТПЧБМПУШ ПДОПЧТЕНЕООП У ХЧЕМЙЮЕОЙЕН ЕНЛПУФЙ, ЛБЛ ЬФП НПЦОП ВЩМП ВЩ РТЕДРПМПЦЙФШ Ч УМХЮБЕ ЬЛЪПГЙФПЪБ Й ЧЛМАЮЕОЙС ЗТБОХМСТОПК НЕНВТБОЩ Ч РМБЪНБФЙЮЕУЛХА (ТЙУ. 11.25). пДОБЛП РТЙНЕТОП 15 % УПВЩФЙК ЧЩУЧПВПЦДЕОЙС УПРТПЧПЦДБМЙУШ ЛТБФЛПЧТЕНЕООЩН Й ОЕРПМОЩН ХЧЕМЙЮЕОЙЕН ЕНЛПУФЙ. ч ЬФЙИ УМХЮБСИ ЬЛЪПГЙФПЪ, РП ЧУЕК ЧЙДЙНПУФЙ, РТПЙУИПДЙМ ЮЕТЕЪ НБМЕОШЛПЕ, ПФЛТЩЧБЕНПЕ ОБ ЛПТПФЛПЕ ЧТЕНС ПФЧЕТУФЙЕ (fusion ТПЗЕ), ЛПФПТПЕ ЪБФЕН ВЩУФТП ЪБЛТЩЧБМПУШ, РПЪЧПМСС ЗТБОХМЕ ПФПКФЙ ПВТБФОП Ч ГЙФПРМБЪНХ ВЕЪ ЧЛМАЮЕОЙС ЕЕ Ч ОБТХЦОХА НЕНВТБОХ (ТЙУ. 11.25D). фБЛЙЕ УПВЩФЙС ФЙРБ «РПГЕМПЧБМ Й ХВЕЦБМ» (kiss and run) НПЗХФ РПЪЧПМЙФШ ПУЧПВПЦДБФШУС НБМЕОШЛЙН НПМЕЛХМБН, ОБРТЙНЕТ, ЛБФЕИПМБНЙОБН, ЮЕК ЪБРБУ НПЦЕФ ВЩФШ ВЩУФТП ЧПУУФБОПЧМЕО, ОП ЪБДЕТЦЙЧБФШ РТЙ ЬФПН ВПМШЫЙЕ ВЕМЛЙ, РПФЕТС ЛПФПТЩИ НПЦЕФ ВЩФШ ЧПУРПМОЕОБ ФПМШЛП РХФЕН УЙОФЕЪБ БВУПМАФОП ОПЧЩИ ЗТБОХМ Ч БРРБТБФЕ зПМШДЦЙ.
|
|
|
йЪНЕОЕОЙС ЕНЛПУФЙ, УЧСЪБООЩЕ У ЧЩУЧПВПЦДЕОЙЕН НОПЦЕУФЧЕООЩИ ЛЧБОФПЧ, ВЩМЙ ЙЪНЕТЕОЩ Ч ПДЙОПЮОЩИ ОЕТЧОЩИ ПЛПОЮБОЙСИ, ЧЩДЕМЕООЩИ ЙЪ гоу РПЪЧПОПЮОЩИ92ћ 93). рПЛБ ЕЭЕ ФЕИОЙЮЕУЛЙ ОЕЧПЪНПЦОП ТЕЗЙУФТЙТПЧБФШ ЙЪНЕОЕОЙЕ ЕНЛПУФЙ, УЧСЪБООЩЕ УП УМЙСОЙЕН ПДЙОПЮОЩИ УЙОБРФЙЮЕУЛЙИ ЧЕЪЙЛХМ. иПФС РПМОПЕ УМЙСОЙЕ УЙОБРФЙЮЕУЛЙИ ЧЕЪЙЛХМ У РТЕУЙОБРФЙЮЕУЛПК НЕНВТБОПК СЧОП РТПЙУИПДЙФ ЧП ЧТЕНС ЙОФЕОУЙЧОПК УФЙНХМСГЙЙ, ПУФБЕФУС ОЕСУОЩН, НПЦЕФ МЙ РТПЙУИПДЙФШ Ч ОПТНБМШОЩИ ЖЙЪЙПМПЗЙЮЕУЛЙИ ХУМПЧЙСИ ЧЩУЧПВПЦДЕОЙЕ РП НЕИБОЙЪНХ «РПГЕМПЧБФШ Й ХВЕЦБФШ»94, 95).
зМБЧБ 11. чЩУЧПВПЦДЕОЙЕ НЕДЙБФПТБљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљ 239

|
| тЙУ. 11.25. хЧЕМЙЮЕОЙЕ ЕНЛПУФЙ НЕНВТБОЩ Й ЧЩУЧПВПЦДЕОЙЕ ЛБФЕИПМБНЙОПЧ ЙЪ ИТПНБЖЖЙООЩИ ЛМЕФПЛ. (б) ьМЕЛФТПД, ЙЪЗПФПЧМЕООЩК ЙЪ ХЗПМШОПЗП ЧПМПЛОБ Й ТБУРПМПЦЕООЩК ЧОХФТЙ РЬФЮ-ЬМЕЛФТПДБ, ЙЪНЕТСЕФ ЧЩУЧПВПЦДЕОЙЕ ЛБФЕИПМБНЙОБ БНРЕТПНЕФТЙЮЕУЛЙН УРПУПВПН, Ч ФП ЧТЕНС ЛБЛ УБН ЬМЕЛФТПД ЙУРПМШЪХЕФУС ДМС ЙЪНЕТЕОЙС ЕНЛПУФЙ Ч РТЕДЕМБИ ТЕЗЙУФТЙТХЕНПЗП ХЮБУФЛБ НЕНВТБОЩ. (ч) пДОПЧТЕНЕООБС ТЕЗЙУФТБГЙС ЧЩУЧПВПЦДЕОЙС ЛБФЕИПМБНЙОПЧ (ЧЧЕТИХ) Й ЕНЛПУФЙ (ЧОЙЪХ). чУЕ УПВЩФЙС ЬЛЪПГЙФПЪБ, ЪБТЕЗЙУФТЙТПЧБООЩЕ РП ЧЩУЧПВПЦДЕОЙА ЛБФЕИПМБНЙОБ, УПЧРБДБАФ У ХЧЕМЙЮЕОЙЕН ЕНЛПУФЙ. (у) ыЕУФПЕ Й УЕДШНПЕ УПВЩФЙС ЬЛЪПГЙФПЪБ (ЙЪ ЮБУФЙ ч ТЙУХОЛБ) РПЛБЪБОЩ ОБ ХЧЕМЙЮЕООПК ЧТЕНЕООПК ЫЛБМЕ. ыЕУФПЕ УПВЩФЙЕ ЬЛЪПГЙФПЬБ УПЧРБДБЕФ У ЛТБФЛПЧТЕНЕООЩН Й ДПЧПМШОП ЫХНСЭЙН ХЧЕМЙЮЕОЙЕН ЕНЛПУФЙ, ЛПФПТБС ДМЙФУС ПЛПМП 5 У. уЕДШНПЕ УПВЩФЙЕ УПЧРБДБЕФ У ВЩУФТЩН Й ДМЙФЕМШОЩН ХЧЕМЙЮЕОЙЕН ЕНЛПУФЙ. (D) лТБФЛПЧТЕНЕООПЕ ХЧЕМЙЮЕОЙЕ ЕНЛПУФЙ НПЦЕФ УППФЧЕФУФЧПЧБФШ ЪЛЪПГЙФПЪХ ЮЕТЕЪ ПФЧЕТУФЙЕ, ПВТБЪХАЭЕЕУС РТЙ ЮБУФЙЮОПН УМЙСОЙЙ ЧЕЪЙЛХМ У НЕНВТБОПК, ЛПФПТЩК ДМЙФУС ЛПТПФЛПЕ ЧТЕНС, ЪБЛБОЮЙЧБСУШ ПФУПЕДЙОЕОЙЕН ЧЕЪЙЛХМЩ ПФ НЕНВТБОЩ Й ХИПДПН ПВТБФОП Ч ГЙФПРМБЪНХ ВЕЪ ЧЛМАЮЕОЙС Ч РМБЪНБФЙЮЕУЛХА НЕНВТБОХ. ч ЪФЙИ ХУМПЧЙСИ НПЗХФ ЧЩУЧПВПЦДБФШУС НБМЕОШЛЙЕ НПМЕЛХМЩ, Ч ФП ЧТЕНС ЛБЛ ВПМШЫЙЕ ВЕМЛЙ ПУФБАФУС ЧОХФТЙ ЧЕЪЙЛХМЩ. Fig. 11.25. Coincident Increases in Membrane Capacitance and Release of Catecholamines from chromaffin cells. (A) A carbon fiber electrode inside the patch pipette measures catecholamine release by amperometry, while at the same time the electrode is used to measure capacitance within the patch. (B) Simultaneous recording of catecholamine release (top trace) and capacitance (bottom trace). All exocytic events detected by catecholamtne release coincide with increases in capacitance. (C) The sixth and seventh exocytic events in part B, displayed on an expanded scale. The sixth exocytic event coincides with a transient flickering increase in capacitance that lasts about 5 s. The seventh exocytic event coincides with an abrupt and long-lasting increase in capacitance. (D) Transient increases in capacitance may correspond to exocytosis through a temporary fusion pore that rapidly closes, allowing the vesicle to pinch back off into the cytoplasm without ever becoming incorporated into the plasma membrane. Under such circumstances small molecules may be released while larger proteins are retained in the vesicle. (After Albillos et aL, 1997.) |
|
|
|
240 тБЪДЕМ II. рЕТЕДБЮБ ЙОЖПТНБГЙЙ Ч ОЕТЧОПК УЙУФЕНЕ
ЧЩЧПДЩ
∙ дЕРПМСТЙЪБГЙС ПЛПОЮБОЙС БЛУПОБ РТЙЧПДЙФ Л ПФЛТЩЧБОЙА РПФЕОГЙБМ-БЛФЙЧЙТХЕНЩИ ЛБМШГЙЕЧЩИ ЛБОБМПЧ, ХЧЕМЙЮЕОЙА ЧОХФТЙЛМЕФПЮОПК ЛПОГЕОФТБГЙЙ ЛБМШГЙС Й ЧЩУЧПВПЦДЕОЙА НЕДЙБФПТБ.
∙ нЕДЙБФПТ ЧЩУЧПВПЦДБЕФУС Ч ЧЙДЕ НХМШФЙНПМЕЛХМСТОЩИ ЛЧБОФПЧ, ЮФП РТПЙУИПДЙФ РТЙ УМЙСОЙЙ УЙОБРФЙЮЕУЛЙИ ЧЕЪЙЛХМ, ЪБРПМОЕООЩИ НЕДЙБФПТПН, У РМБЪНБФЙЮЕУЛПК НЕНВТБОПК Й ЧЩУЧПВПЦДЕОЙЙ ЙИ УПДЕТЦЙНПЗП РХФЕН ЬЛЪПГЙФПЪБ. рПНЙНП ЬФПЗП УХЭЕУФЧХЕФ ФБЛЦЕ РПУФПСООБС ОЕЛЧБОФПЧБС ХФЕЮЛБ НЕДЙБФПТБ ЙЪ ПЛПОЮБОЙК БЛУПОПЧ Ч УПУФПСОЙЙ РПЛПС.
∙ уЙОБРФЙЮЕУЛБС ЪБДЕТЦЛБ НЕЦДХ ОБЮБМПН РТЕУЙОБРФЙЮЕУЛПК ДЕРПМСТЙЪБГЙЙ Й ОБЮБМПН РПУФУЙОБРФЙЮЕУЛПЗП РПФЕОГЙБМБ ПВХУМПЧМЕОБ ЧТЕНЕОЕН, ОЕПВИПДЙНЩН ДМС ДЕРПМСТЙЪБГЙЙ ОЕТЧОПЗП ПЛПОЮБОЙС, ПФЛТЩЧБОЙС ЛБМШГЙЕЧЩИ ЛБОБМПЧ Й ХЧЕМЙЮЕОЙС ЧОХФТЙЛМЕФПЮОПК ЛПОГЕОФТБГЙЙ ЛБМШГЙС, ЛПФПТЩК ЪБРХУЛБЕФ РТПГЕУУ ЬЛЪПГЙФПЪБ.
∙ ч РПЛПЕ ЬЛЪПГЙФПЪ РТПЙУИПДЙФ У ОЙЪЛПК ЮБУФПФПК, ЧЩЪЩЧБС УРПОФБООЩК НЙОЙБФАТОЩК УЙОБРФЙЮЕУЛЙК РПФЕОГЙБМ. ч ПФЧЕФ ОБ РПФЕОГЙБМ ДЕКУФЧЙС ПФ 1 ДП 300 ЛЧБОФПЧ (Ч ЪБЧЙУЙНПУФЙ ПФ ФЙРБ УЙОБРУБ) ЧЩУЧПВПЦДБЕФУС РТБЛФЙЮЕУЛЙ ПДОПЧТЕНЕООП.
∙ уЙОБРФЙЮЕУЛЙЕ ЧЕЪЙЛХМЩ УПДЕТЦБФ ОЕУЛПМШЛП ФЩУСЮ НПМЕЛХМ НЕДЙБФПТБ. лПМЙЮЕУФЧП РПУФУЙОБРФЙЮЕУЛЙИ ТЕГЕРФПТПЧ, БЛФЙЧЙТХЕНЩИ ПДОЙН ЛЧБОФПН НЕДЙБФПТБ, ЧБТШЙТХЕФ ЪОБЮЙФЕМШОП, Ч РТЕДЕМБИ ПФ 15 ДП 1 500, Ч ЪБЧЙУЙНПУФЙ ПФ ФЙРБ УЙОБРУПЧ.
∙ тБУРТЕДЕМЕОЙЕ БНРМЙФХД УРПОФБООЩИ НЙОЙБФАТОЩИ Й ЧЩЪЧБООЩИ РПУФУЙОБРФЙЮЕУЛЙИ РПФЕОГЙБМПЧ НПЦЕФ ВЩФШ РТПБОБМЙЪЙТПЧБОП УФБФЙУФЙЮЕУЛЙНЙ НЕФПДБНЙ ДМС ПРТЕДЕМЕОЙС ТБЪНЕТБ ЛЧБОФБ Й ЛЧБОФПЧПЗП УПУФБЧБ. ьЖЖЕЛФЙЧОПУФШ УЙОБРФЙЮЕУЛПК РЕТЕДБЮЙ НПЦЕФ НПДХМЙТПЧБФШУС ОБ РТЕУЙОБРФЙЮЕУЛПН ХТПЧОЕ ЪБ УЮЕФ ЙЪНЕОЕОЙС ЛЧБОФПЧПЗП УПУФБЧБ, Б ФБЛЦЕ ОБ РПУФУЙОБРФЙЮЕУЛПН ХТПЧОЕ ЪБ УЮЕФ ЙЪНЕОЕОЙС ТБЪНЕТБ ЛЧБОФБ.
∙ ч ТЕЪХМШФБФЕ ЬЛЪПГЙФПЪБ НЕНВТБОЩ УЙОБРФЙЮЕУЛЙИ ЧЕЪЙЛХМ НПЗХФ УМЙЧБФШУС У РМБЪНБФЙЮЕУЛПК НЕНВТБОПК. лПНРПОЕОФЩ ЧЕЪЙЛХМСТОПК НЕНВТБОЩ ЪБФЕН УРЕГЙЖЙЮОП ЪБИЧБФЩЧБАФУС ПВТБФОП РХФЕН ЬОДПГЙФПЪБ РПЛТЩФЩИ ЧЕЪЙЛХМ Й ТЕГЙЛМЙТХАФУС РТЙ ЖПТНЙТПЧБОЙЙ ОПЧЩИ УЙОБРФЙЮЕУЛЙИ ЧЕЪЙЛХМ. ч ПРТЕДЕМЕООЩИ ХУМПЧЙСИ ЧЩУЧПВПЦДЕООЩЕ ЧЕЪЙЛХМЩ НПЗХФ ЧПЪЧТБЭБФШУС ПВТБФОП Ч ГЙФПРМБЪНХ ВЕЪ ЧЛМАЮЕОЙС Ч ЛМЕФПЮОХА НЕНВТБОХ.
ТЕЛПНЕОДХЕНБС МЙФЕТБФХТБ
ПВЪПТЩ
П Cochilla, A. J., Angleson, J. л., and Betz, W. J. 1999. Monitoring secretory membrane with FM1-43 fluorescence. Annu Rev. Neurosd. 22: 1-10.
П Llinàs, R. 1982. Calcium in synoptic transmission. Sci. Am. 247(4): 56-65.
П Olivera, B. M., Miljanich, G. P., Ramachandran, J., and Adams, M. E. 1994. Calcium channel diversity and neurotransmitier release: The omega-conotoxins and omega-agatoxins. Annu. Rev. Biochem. 63: 823-867.
П Parnas, H., Segel, L., Dudel, J., and Parnas, I. 2000. Autoreceptors, membrane potenlial and the regulation of transmitter release. Trends Neurosd. 23: 60-68.
П Redman, S. 1990. Quanta! analysis of synaptic potentials in neurons of the central nervous system. Physio/. Rev. 70: 165-198.
П Walmsley, ч., Alvarez, F.J., and Fyffe, R. E.W. 1998. Diversity of structure and function at mammalian central synapses. Trends Neurosd. 21: 81-88.
П Zucker, R. S. 1993. Calcium and transmitter release. /. Physio/. (Paris) 87: 25-36.
УФБФШЙ
П Adler, Ε. Μ., Augustine, G. J., Duffy, S. N., and Charlton, M. P. 1991. Alien intracellular calcium chelators attenuate neurotransmitter release at the squid giant synapse. /. Neurosd. 11: 1496-1507.
П Betz, W. J., and Bewick, O.S. 1993. Optical monitoring of transmitter release and synaptic vesicle recycling at the frog neuromuscular junction. /. Physiol. 460: 287-309.
П Boyd, I. A., and Martin, A. R. 1956. The end-plate potential in mammalian muscle. /. Physiol. 132: 74-91.
П del Castillo, J., and Katz, B. 1954. Quanta! components of the end-plate potential. /. Physiol. 124: 560-573.
П Edwards, F. A., Konnerth, A., and Sakmann, B. 1990. Quanta! analysis of inhibitory synaptic transmission in the dentate gyrus of rat hippocam-pal slices: A patch-clamp study. /. Physiol. 430: 213-249.
зМБЧБ 11. чЩУЧПВПЦДЕОЙЕ НЕДЙБФПТБљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљ 241
П Fatt, P., and Katz, ч. 1952. Spontaneous sub-threshold potentials at motor nerve endings. /. Physiol. 117: 109-128.
П Fernandez, J. M., Neher, E., and Gomperts, B. D. 1984. Capacitance measurements reveal stepwise fusion events in degranulating mast cells. Nature 312: 453-455.
П Heuser, J. E., and Reese, T. S. 1973. Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction. /. CellBiol. 57: 315-344.
П Heuser, J. E., Reese, T. S., Dennis, M. L, Jan, Y., Jan, L., and Evans, L. 197,9. Synaptic vesicle ex-ocytosis captured by quick freezing and correlated with quanta! transmitter release. /. Cell Biol 81: 275-300.
П Katz, ч., and Miledi, R. 1967. A study of synaptic transmission in the absence of nerve impulses. /. Physiol. 192: 407-436.
П Katz, ч., and Miledi, R. 1967. The timing of calcium action during neuromuscular transmission. /. Physiol. 189: 535-544.
П Kuffler, S. W., and Yoshikami, D. 1975. The number of transmitter molecules in a quantum: An estimate from iontophoretic application of acetyl-choline at the neuromuscular synapse. /. Physiol. 251:465-482.
П Llinàs, R., Sugimori, M., and Silver, R.B. 1992. Microdomains of high calcium concentration in a presynaptic terminal. Science 256: 677-679.
П Miller, T.M., and Heuser, J.E. 1984. Endocytosis of synaptic vesicle membrane at the frog neuromuscular junction. /. Cell Biol. 98: 685-698.
П Ryan, T.A., Reuter, R, and Smith, S. J. 1997. Optical detection of a quantal presynaptic membrane turnover. Nature 388: 478-482.
П Steyer, J. A., Horstmann, H., and Aimers, W. 1997. Transport, docking and exocytosis of single secretory granules in live chromaffin cells. Nature 388: 474-478.
ГЙФЙТПЧБООБС МЙФЕТБФХТБ
1. Morita, л., and Barrett, E. F. 1990. / Neurosci. 10: 2614-2625.
2. Bullock, T. H., and Hagiwara, S. 1957. /. Gen. Physiol. 40: 565-577.
3. Heidelberger, R., and Matthews, G. 1992. /. Physiol. 447: 235-256.
4. Martin, A. R., and Pilar, G. 1963. / Physiol. 168: 443-463.
5. Borst, J. G. G., and Sakmann, B. 1996. Nature 383: 431-434.
6. Katz, ч., and Miledi, R. 1967. J. Physiol. 192: 407-436.
7. Katz, ч., and Miledi, R. 1965. J. Physiol. 181: 656-670.
8. Parnas, H., Segel, L., Dudel, J., and Parnas, I. 2000. Trends Neurosci. 23: 60-68.
9. del Castillo, J., and Stark, L. 1952. / Physiol. 116: 507-515.
10. Dodge, F. A., Jr., and Rahamimoff, R. 1967. /. Physiol. 193: 419-432.
11. Schwartz, E.A. 1987. Science 238: 350-355.
12. Penner, R., and Neher, E. 1988. /. Exp. Biol. 139: 329-345.
13. Kasai, H. 1999. Trends Neurosci. 22: 88-93.
14. Katz, ч., and Miledi, R. 1967. /. Physiol. 189: 535-544.
15. Llinàs, R. 1982. Sci. Am. 247(4): 56-65.
16. Llinàs, R., Sugimori, M., and Silver, R. B. 1992. Science 256: 677-679.
17. Adler, E. M., et al. 1991. /. Neurosci. 11: 1496-1507.
18. Hochner, ч., Parnas, H., and Parnas, I. 1989. Nature 342: 433-435.
19. Delany, K. R., and Zucker, R.S. 1990. J. Physiol. 426: 473-498.
20. Zucker, R.S. 1993. /. Physiol. (Paris) 87: 25-36.
21. Heidelberger, R., et al. 1994. Nature 371: 513-515.
22. Linial, M., Ilouz, N.. and Parnas, H. 1997. /. Physiol. 504: 251-258.
23. Fatt, P., and Katz, B. 1952. /. Physiol. 117: 109-128.
24. Kuffler, S. W., and Yoshikami, D. 1975. /. Physiol. 251: 465-482.
25. del Castillo, J., and Katz, B. 1954. /. Physiol. 124: 586-604.
26. Brooks, V. B. 1956. /. Physiol. 134: 264-277.
27. Birks, R., Katz, ч., and Miledi, R. 1960. /. Physiol. 150: 145-168.
28. Reiser, G., and Miledi, R. 1989. Brain Res. 479: 83-97.
29..Katz, ч., and Miledi, R. 1977. Proc. R.Soc. Land.
ч 196: 59-72.
30. Vyskocil, F., Nikolsky, E., and Edwards, C. 1983. Neuroscience 9: 429-435.
31. del Castillo, J., and Katz, B. 1954. /. Physiol. 124: 560-573.
32. Johnson, E.W., and Wernig, A. 1971. /. Physiol. 218: 757-767.
33. Rahamimoff, R., and Fernandez, J. M. 1997. Pre-and postfusion regulation of transmitter release. Neuron 18: 17-27.
34. Stjurne, L., et al. 1994. Molecular and Cellular Mechanisms of Neurotransmitter Release. Raven, New York.
242 тБЪДЕМ II. рЕТЕДБЮБ ЙОЖПТНБГЙЙ Ч ОЕТЧОПК УЙУФЕНЕ
35. Blackmail, J. G., and Purves, R. D. 1969. /. Physio/. 203: 173-198.
36. Martin, A.R., and Pilar, G. 1964. /. Physiol. 175: 1-16.
37. Redman, S. 1990. Physiol. Rev. 70: 165-198.
38. Edwards, F. A., Konnerth, A., and Sakmann, B. 1990. /. Physiol. 430: 213-249.
39. Kuno, M. 1964. /. Physiol. 175: 81-99.
40. Walmsley, ч., Alvarez, F.J., and Fyffe, R.E.W. 1998. Trends Neurosci. 21: 81-88.
41. Bekkers, J. M. 1994. уЙ/З. Opin. Neurobiol. 4: 360-365.
42. Magleby, K. L., and Weinstock, M. M. 1980. /. Physiol. 299: 203-218.
43. Katz, ч., and Miledi, R. 1972. / Physiol. 244: 665-699.
44. Gold, M. R., and Martin, A. R. 1983. /. Physiol. 342: 85-98.
45. Jonas, P., Major, G., and Sakmann, B. 1993. /. Physiol. 472: 615-663.
46. Villanueva, S., Fiedler, J., and Orrego, F. 1990. Neuroscience 37: 23-30.
47. Hartzell, H.C., Kuffler, S.W., and Yoshikami, D, 1975. /. Physiol. 251: 427-463.
48. Salpeter, M. M. 1987. In The Vertebrate Neuromus-cular Junction. Alan R. Liss, New York, pp. 1-54.
49. Harris, K. M., and Landis, D. M. M. 1986. Neuro-science 19: 857-872.
50. Schikorski, T., and Stevens, C. F. 1997. /. Neurosci 17: 5858-5867.
51. Denis, M, J., and MHedi, R. 1974. /. Physiol. 239: 571-594.
52. Erxleben, C. and Kriebel, M. E. 1988. /. Physiol. 400: 659-676.
53. Vautrin, J., and Kriebel, M. E. 1991. Neuroscience 41: 71-88.
54. Drachman, D. B. 1994. New England J. Med. 330: 1797-1810.
55. Reger, J.F. WSS.Anat. Rec. 130: 7-23.
56. Birks, R., Huxley, H. E., and Katz, B. 1960. /. Physiol. 150: 134-144.
57. Robitaille, R., Adler, E. M., and Charlton, M. R
1990. Neuron 5: 773-779.
58. Cohen, M.W., Jones, O.T., and Angelides, K. J.
1991. /. Neurosci. 11: 1032-1039.
59. Sugiura, Y, et al. 1995. J. Neurocytol. 24: 15-27.
60. Olivera, B. M., et al. 1994. Annu. Rev. Biochem. 63: 823-867.
61. Heuser, J. E., Reese, T.S., and Landis, D. M. D. 1974. /. Neurocytol. 3: 109-131.
62. Peper, K., et al. 1974. Cell Tissue Res. 149:437-455.
63. Porter, C.W., and Barnard, E.A. 1975. /. Membr. Biol. 20: 31-49.
64. Kirshner, N. 1969. Adv. Biochem. Psychopharmacol. 1:71-89.
65. Smith, A. D., et al. 1970. Tissue Cell 2: 547-568.
66. Silinsky, E. M., and Redman, R. S. 1996. /. Physiol. 492: 815-822.
67. Wagner, J. A., Carlson, S. S., and Kelly, R. B. 1978. Biochemistry 17: 1199-1206.
68. Heuser, J. E., et al. 1979. /. Cell Biol. 81: 275-300.
69. Heuser, J. E., and Reese, T. S. 1981. /. Cell Biol. 88: 564-580.
70. Lang, T., et al. 1997. Neuron 18: 857-863.
71. Steyer, J.A., Horstmann, H., and Aimers, W. 1997. Nature 388: 474-478.
72. Steyer, J.A., and Aimers, W. 1999. Biophys. J. 76: 2262-2271.
73. Oheim, M., et al. 1999. Philos. Trans. R. Soc. Land. £354:307-318.
74. Dunant, Y, and Israel, M. 1998. Neurochem. Res. 23: 709-718.
75. Cammack, J.N., and Schwartz, E.A. 1993. / Physiol. 472: 81-102.
76. Cammack, J. N., Rakhilin, S.V., and Schwartz, E.A. 1994. Neuron 13: 949-960.
77. Ceccarelli, ч., and Hurlbut, W. P. 1980. Physiol. Rev. 60: 396-441.
78. Dickinson-Nelson, A., and Reese, T. S. 1983. /. Neurosci. 3: 42-52.
79. Wickelgren, W. O., et al. 1985. J. Neurosci. 5: 1188-1201.
80. Heuser, J. E., and Reese, T.S. 1973. /. Cell Biol. 57: 315-344.
81. Valtorta, F., et al. 1988. J. Cell Biol. 107: 2717-2727.
82. Miller, T.M., and Heuser, J.E. 1984. /. Cell Biol. 98: 685-698.
83. Cochilla, A. J., Angleson, J. K., and Betz, W. J. 1999. Annu. Rev. Neurosci. 22: 1-10.
84. Betz, W. J., and Bewick, G. S. 1993. /. Physiol. 460: 287-309.
85. Ryan, T.A., et al. 1993. Neuron 11: 713-724.
86. Teng, H., et al. 1999. J. Neurosci. 19: 4855-4866.
87. Ryan, T.A., Reuter, H., and Smith, S.J. 1997. Nature 388: 478-482.
88. Penner, R., and Neher, E. 1989. Trends Neurosci. 12: 159-163.
89. Angleson, J. K., and Betz, W. J. 1997. Trends Neurosci. 20: 281-287.
90. Fernandez, J. M., Neher, E., and Gomperts, B. D. 1984. Nature 312: 453-455.
91. Albillos, A., et al. 1997. Nature 389: 509-512.
92. Lim, N. F., Nowycky, M.C., and Bookman, R.J. 1990. Nature 344: 449-451.
93. von Gersdorff, H., and Matthews, G. 1997. /. Neurosci. 17: 1919-1927.
94. Fesce, R., et al. 1994. Trends Cell чщ. 4: 1-4.
95. KJingauf, J., Kavalali, E. T., and Tsien, R. W. 1998. Nature 394: 581-585.
|
|
|


