 |
Чщъчбообс бзтйопн уйобрфйюеулбс дйжжетеогй тпчоб
|
|
|
|
бЗТЙО УХЭЕУФЧХЕФ Ч ОЕУЛПМШЛЙИ ЙЪПЖПТНБИ. ЛПФПТЩЕ ЧПЪОЙЛБАФ ЧУМЕДУФЧЙЕ БМШФЕТОБФЙЧОПЗП УРМБКУЙОЗБ ПДОПЗП ЗЕОБ142). нПФПОЕКТПОЩ, НЩЫЕЮОЩЕ ЛМЕФЛЙ Й ЫЧБООПЧУЛЙЕ ЛМЕФЛЙ ЬЛУРТЕУУЙТХАФ БЗТЙО, ОП ФПМШЛП Х
558љљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљ тБЪДЕМ IV. тБЪЧЙФЙЕ ОЕТЧОПК УЙУФЕНЩ

| тЙУ. 23.29. бЛУПОЩ ЧЩЪЩЧБАФ БЗТЕЗБГЙА ТЕГЕРФПТПЧ БГЕФЙМИПМЙОБ Ч ПВМБУФСИ ЛПОФБЛФБ У НЩЫЕЮОЩНЙ ЛМЕФЛБНЙ. жБЪПЧП ЛПОФТБУФОЩЕ (A. ч) Й ЖМХПТЕУГЕОФОЩЕ (у, D) НЙЛТПЖПФПЗТБЖЙЙ ОЕТЧОП-НЩЫЕЮОПК ЛХМШФХТЩ ЛМЕФПЛ Xenopus. тЕГЕРФПТЩ БГЕФЙМИПМЙОБ ПЛТБЫЕОЩ РТЙ РПНПЭЙ ТПДБНЙО a -ВХОЗБТПФПЛУЙОБ. (б, у) дП Й УТБЪХ РПУМЕ ЛПОФБЛФБ ОБ НЙПГЙФЕ ЙНЕАФУС УРПОФБООП ПВТБЪПЧБООЩЕ ЛМБУФЕТЩ ТЕГЕРФПТПЧ би. (ч, D) юЕТЕЪ 24 Ю УРПОФБООП ПВТБЪПЧБЧЫЙЕУС ПВМБУФЙ ТЕГЕРФПТПЧ би ЙУЮЕЪМЙ Й ПВТБЪПЧБМЙУШ ОПЧЩЕ ПВМБУФЙ ОЕРПУТЕДУФЧЕООП Ч ПВМБУФЙ БЛУПОБМШОПЗП ЛПОФБЛФБ. Fig. 23.29. Axons Induce Aggregation of Acetylcholine Receptors at sites of contact with muscle cells. Phase-contrast (A, B) and fluorescence (C, D) micrographs of a Xenopus neuron-muscle cell culture. Acetylcholine receptors are labeled with rhodamine Q-bungarotoxin. (A,C) Before and immediately after contact there are spontaneous clusters of ACh receptors on the myocyte. (B, D) After 24 h, the spontaneous AChR patches have disappeared and new patches have been induced to form beneath the axon. (From Anderson and Cohen, 1977; micrographs kindly provided by M.Cohen.) |
НПФПОЕКТПОПЧ БЗТЙО ОБИПДЙФУС Ч ФБЛПК ЙЪПЖПТНЕ, ЛПФПТБС УРПУПВОБ ЧЩЪЩЧБФШ РПУФУЙОБРФЙЮЕУЛХА ДЙЖЖЕТЕОГЙТПЧЛХ. бЗТЙО СЧМСЕФУС ВПМШЫПК НПМЕЛХМПК (heparan sulfate proteoglyУБР), ДПНЕОЩ ЛПФПТПК ЧЪБЙНПДЕКУФЧХАФ У МБНЙЙЙОПН, ВЕМЛБНЙ, УЧСЪЩЧБАЭЙНЙ ЗЕРБТЙО, a -ДЙУФТПЗМЙЛБОПН, ЗЕРБТЙОПН Й ЙОФЕЗТЙОБНЙ (ТЙУ. 23.30)143). уРПУПВОПУФШ ЙОДХГЙТПЧБФШ ПВТБЪПЧБОЙЕ РПУФУЙОБРФЙЮЕУЛПК УРЕГЙБМЙЪБГЙЙ Ч ПУОПЧОПН ЪБЧЙУЙФ ПФ у-ЛПОГЕЧПЗП ДПНЕОБ.
чЕДХЭБС ТПМШ БЗТЙОБ Ч ЖПТНЙТПЧБОЙЙ ОЕТЧОП-НЩЫЕЮОПЗП УПЕДЙОЕОЙС ОБЙВПМЕЕ ПЮЕЧЙДОБ Х НЩЫЕК, Х ЛПФПТЩИ РТЙ РПНПЭЙ ЗПНПМПЗЙЮОПК ТЕЛПНВЙОБГЙЙ ЧЩЛМАЮЕОБ ЬЛУРТЕУУЙС ЗЕОБ БЗТЙОБ144ћ 145). рТЙ ФБЛПН ЧЩЛМАЮЕОЙЙ ЗЕОБ НЩЫЕЮОЩЕ ЧПМПЛОБ ЧЩЗМСДСФ ОПТНБМШОП Й БЛУПО ТБУФЕФ Ч ОБРТБЧМЕОЙЙ ТБЪЧЙЧБАЭЙИУС НЩЫГ, ПДОБЛП ОЕТЧОП-НЩЫЕЮОЩЕ УПЕДЙОЕОЙС ОЕ ПВТБЪХАФУС. рПДПВОЩК ЦЕ ЖЕОПФЙР ОБВМАДБЕФУС Х НЩЫЕК, Х ЛПФПТЩИ ЧЩЛМАЮЕО УЙОФЕЪ НЩЫЕЮОП-УРЕГЙЖЙЮЕУЛПЗП ТЕГЕРФПТБ ФЙТПЪЙОЛЙОБЪЩ MuSK146). ьФП ОБЧПДЙФ ОБ НЩУМШ, ЮФП MuSK ЖПТНЙТХЕФ ЮБУФШ ТЕГЕРФПТБ Л БЗТЙОХ Й ЮФП ЧЩЪЧБООПЕ БЗТЙОПН БХФПЖПУЖПТЙМЙТПЧБОЙЕ MuSK ЪБРХУЛБЕФ ЧОХФТЙЛМЕФПЮОЩК УЙЗОБМШОЩК ЛБУЛБД, ЛПФПТЩК РТЙЧПДЙФ Л ЖПТНЙТПЧБОЙА ОЕПВИПДЙНЩИ ЛПНРПОЕОФПЧ Ч РПУФУЙОБРУЕ (ТЙУ. 23.31). пДОЙН ЙЪ ОБЙВПМЕЕ ЧБЦОЩИ ЛПНРПОЕОФПЧ СЧМСЕФУС ТБРУЙО (rapsyn), ВЕМПЛ, ЛПФПТЩК, ЛБЛ УЮЙФБЕФУС, ЙЗТБЕФ ТПМШ Ч РЕТЕДБЮЕ УЙЗОБМПЧ НЕЦДХ ТЕГЕРФПТБНЙ би, MuSK, a- Й b -ДЙУФТПЗМЙЛБОБНЙ Й ЮМЕОБНЙ Src УЕНЕКУФЧБ ГЙФПРМБЪНБФЙЮЕУЛЙИ ТЕГЕРФПТПЧ ФЙТПЪЙОЛЙОБЪ147). фБЛЙН ПВТБЪПН, Ч ОЕТЧОП-НЩЫЕЮОПН УПЕДЙОЕОЙЙ НХФБОФОШЗИ НЩЫЕК У ДЕЖЙГЙФПН ТБРУЙОБ РТПЙУИПДЙФ ОБЛПРМЕОЙЕ MuSK Й ЧЩВПТПЮОБС ЬЛУ-
|
|
|
зМБЧБ 23. тБЪЧЙФЙЕ ОЕТЧОПК УЙУФЕНЩљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљ 559
| тЙУ. 23.30. бЗТЙО РТЕДУФБЧМСЕФ УПВПК ЗЕРБТБО-УХМШЖБФ РТПФЕПЗМЙЛБОБ ВПМШЫПК НБУУЩ (400-600 ЛдБ). еЗП ДПНЕОЩ ЧЪБЙНПДЕКУФЧХАФ У МБНЙОЙОПН, ЗЕРБТБО УХМШЖБФ РТПФЕПЗМЙЛБОБНЙ (HSPGs), ЗЕРБТЙОПН, a -ДЙУФТПЗМЙЛБОПН, ЙОФЕЗТЙОПН, ЗЕРБТЙОУЧСЪЩЧБАЭЙНЙ ВЕМЛБНЙ Й ТЕГЕРФПТБНЙ БЗТЙОБ, ЛПФПТЩЕ ЧЩЪЩЧБАФ БЗТЕЗБГЙА ТЕГЕРФПТПЧ би. (б) ьМЕЛФТПООБС НЙЛТПЖПФПЗТБЖЙС БЗТЙОБ РПУМЕ rotatory shadowing*). (ч) уИЕНБФЙЮЕУЛБС ДЙБЗТБННБ УФТХЛФХТОЩИ Й УЧСЪЩЧБАЭЙИУС ДПНЕОПЧ БЗТЙОБ ГЩРМЕОЛБ. EG — ДПНЕО, РПДПВОЩК ЬРЙДЕТНБМШОПНХ ЖБЛФПТХ ТПУФБ; FS — ДПНЕО, РПДПВОЩК ЖПМЙПУФБФЙОХ; LE — ДПНЕО, РПДПВОЩК МБНЙОЙОХ EGF; LG — ДПНЕО, РПДПВОЩК МБНЙОЙОХ G; SEA — РПУМЕДПЧБФЕМШОПУФШ, ПВОБТХЦЕООБС Ч ВЕМЛБИ УРЕТНЩ НПТУЛПЗП ЕЦБ, ЬОФЕТПЛЙОБЪБИ Й БЗТЙОЕ; S/T — ДПНЕОЩ, ВПЗБФЩЕ УЕТЙОПН Й/ЙМЙ ФТЕПОЙОПН. фБЛЦЕ РПЛБЪБОЩ ПВМБУФЙ УЧСЪЩЧБОЙС. зМПВХМСТОЩЕ (1, 3-5) Й ЧЩФСОХФЩЕ (2) ПВМБУФЙ НПМЕЛХМЩ НПЦОП ХЧЙДЕФШ Ч ЮБУФЙ б. | 
|
|
|
|
| Fig. 23.30. Agrin Is a Large Heparan Sulfate Proteoglycan (400 to 600 kDa) with domains that interact with lamimn, heparan sulfate proteoglycans (HSPGs), heparin, a-dystroglycan, integrin, heparin-binding proteins, and the agrin receptor that causes AChR aggregation. (A) Electron micrographs of agrin after rotary shadowing. (B) Schematic diagram of the structural and binding domains of chick agrin. |  EG - epidermal growth factor-like domain; FS --follistatin-like domain;LE - laminin EGF-like domain; LG «laminin G-like domain; SEA «motif found in sea urchin sperm protein, enterokinase, and agrin; S/T = serine and/or threonine-rich domain. Binding regions are indicated, as are globular (1, 3-5) and extended (2) regions of the molecule that can be recognized in part A. (After Denzer et aL, 1998; micrograph kindly provided by M. Rueg.)
EG - epidermal growth factor-like domain; FS --follistatin-like domain;LE - laminin EGF-like domain; LG «laminin G-like domain; SEA «motif found in sea urchin sperm protein, enterokinase, and agrin; S/T = serine and/or threonine-rich domain. Binding regions are indicated, as are globular (1, 3-5) and extended (2) regions of the molecule that can be recognized in part A. (After Denzer et aL, 1998; micrograph kindly provided by M. Rueg.)
|
РТЕУУЙС ЗЕОБ ТЕГЕРФПТБ би Ч СДТЕ, Б ФБЛЦЕ ЖПТНЙТХАФУС ОЕЛПФПТЩЕ ИБТБЛФЕТОЩЕ ДМС УЙОБРУБ УЧПКУФЧБ, ПДОБЛП ОЕ РТПЙУИПДЙФ ОБЛПРМЕОЙС ТЕГЕРФПТПЧ би.
уТЕДЙ ВЕМЛПЧ, ЛПФПТЩЕ ОБЛБРМЙЧБАФУС Ч ПФЧЕФ ОБ ЙЪНЕОЕОЙС Ч УЙОБРУЕ РПД ДЕКУФЧЙЕН БЗТЙОБ, ОБИПДЙФУС ARIA, ЮМЕО УЕНЕКУФЧБ ВЕМЛПЧ ОЕКТЕЗХМЙОПЧ (neuregulin) Й ВЕМЛЙ ТЕГЕРФПТПЧ ОЕКТЕЗХМЙОПЧ erbч2, erbчъ Й erbч4148). бЛФЙЧБГЙС erbч ТЕГЕРФПТПЧ Ч НЩЫГЕ РТЙЧПДЙФ Л ЬЛУРТЕУУЙЙ УЙОБРФЙЮЕУЛЙИ УХВЯЕДЙОЙГ ТЕГЕРФПТБ би.
зПТБЪДП НЕОШЫЕ ЙЪЧЕУФОП П ДЙЖЖЕТЕОГЙТПЧЛЕ РТЕУЙОБРФЙЮЕУЛПК ОЕТЧОПК ФЕТНЙОБМЙ. ьЛУРЕТЙНЕОФЩ нБЛнБИБОБ РПЛБЪБМЙ, ЮФП НПМЕЛХМЩ, РТПЮОП УЧСЪБООЩЕ У УЙОБРФЙЮЕУЛПК ВБЪБМШОПК НЕНВТБОПК ЧП ЧЪТПУМПК НЩЫГЕ, НПЗХФ ЧЩЪЩЧБФШ ЖПТНЙТПЧБОЙЕ БЛФЙЧОЩИ ЪПО Ч ТЕЗЕОЕТЙТХАЭЙИ БЛУПОБИ141). пФУХФУФЧЙЕ РТЕУЙОБРФЙЮЕУЛПК УРЕГЙБМЙЪБГЙЙ Х НХФБОФОЩИ НЩЫЕК У ДЕЖЙГЙФПН БЗТЙОБ Й MuSK НПЦЕФ ЗПЧПТЙФШ П ФПН, ЮФП ЧП ЧТЕНС ТБЪЧЙФЙС РТЕУЙОБРФЙЮЕУЛБС ДЙЖЖЕТЕОГЙТПЧЛБ ХРТБЧМСЕФУС ТЕФТПЗТБДОЩНЙ УЙЗОБМБНЙ У НЩЫЕЮОЩИ ЛМЕФПЛ Ч ПФЧЕФ ОБ ЧЩДЕМЕОЙЕ БЗТЙОБ145). пДОЙН ЙЪ ФБЛЙИ ТЕФТПЗТБДОЩИ УЙЗОБМПЧ, УЧСЪБООЩИ У ВБЪБМШОПК РМБУФЙОЛПК, СЧМСЕФУС МБНЙОЙО b 2; ПО ОБЛБРМЙЧБЕФУС ЧП ЧТЕНС ЙЪНЕОЕОЙК Ч РПУФУЙОБРУЕ Ч ПФЧЕФ ОБ БЗТЙО149), Й Х НХФБОФОЩИ НЩЫЕК, Х ЛПФПТЩИ ЙНЕЕФУС ДЕЖЙГЙФ МБНЙОЙОБ- b 2, ЙНЕАФУС СЧОЩЕ БОПНБМЙЙ РТЕУЙОБРФЙЮЕУЛПК ДЙЖЖЕТЕОГЙТПЧЛЙ150).
*) Rotary shadowing — ФЕИОЙЛБ, ТБЪТБВПФБООБС Ч 1983 ЗПДХ вБЛХПМФЕТПН Й тПЪЕОВЕТЗПН ДМС ЬМЕЛФТПООПЗП НЙЛТПУЛПРЙТПЧБОЙС ЧЩУПЛПНПМЕЛХМСТОЩИ ВЕМЛПЧ. — рТЙН РЕТЕЧ.
560љљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљљ тБЪДЕМ IV. тБЪЧЙФЙЕ ОЕТЧОПК УЙУФЕНЩ
| тЙУ. 23.31. чЪБЙНПДЕКУФЧЙЕ БЗТЙОБ У MuSK ЪБРХУЛБЕФ ДЙЖЖЕТЕОГЙТПЧЛХ РПУФУЙОБРФЙЮЕУЛЙИ ПВТБЪПЧБОЙК Ч НЩЫЕЮОПК ЛМЕФЛЕ, ЗДЕ ОБЮЙОБАФ ОБЛБРМЙЧБФШУС ТЕГЕРФПТЩ би, ТБРУЙО Й ДЙУФТПЗМЙЛБОЩ уЧСЪЩЧБОЙЕ БЗТЙОБ У MuSK ФТЕВХЕФ ЛПТЕГЕРФПТБ ОЕЙДЕОФЙЖЙГЙТПЧБООПЗП ФЙРБ (MASK) Й РТЙЧПДЙФ Л БХФПЖПУЖПТЙМЙТПЧБОЙА ФЙТПЪЙОБ MuSK Й БЛФЙЧБГЙЙ ЧОХФТЙЛМЕФПЮОЩИ ЛЙОБЪ Src Й Fyn. бЛФЙЧЙТПЧБООЩК MuSK ЪБИЧБФЩЧБЕФ ТБРУЙО РПУТЕДУФЧПН ОЕЙДЕОФЙЖЙГЙТПЧБООПЗП ФТБОУНЕНВТБООПЗП ВЕМЛБ, RATL. тБРУЙО, Ч УЧПА ПЮЕТЕДШ, ЪБИЧБФЩЧБЕФ ДЙУФТПЗМЙЛБО Й ТЕГЕРФПТЩ би, ЛПФПТЩЕ ЖПУЖПТЙМЙТХАФУС РП ПУФБФЛБН ФЙТПЪЙОБ Ч b -УХВЯЕДЙОЙГЕ. юЕТЕЪ ЧЪБЙНПДЕКУФЧЙЕ У ДЙУФТПЗМЙЛБОПН РТПЙУИПДЙФ ОБЛПРМЕОЙЕ ВПМШЫПЗП ЛПМЙЮЕУФЧБ ДПРПМОЙФЕМШОЩИ УЙОБРФЙЮЕУЛЙИ ЖБЛФПТПЧ (ОЕ РПЛБЪБОП). | 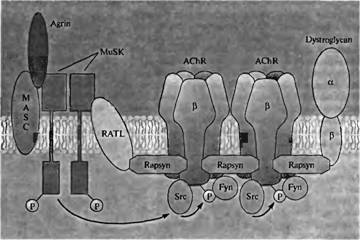 Fig. 23.31. Interaction of Agrin with MuSK triggers differentiation of postsynaptic specializations in muscle cells at which ACh receptors, rapsyn, and dystroglycan accumulate. Binding of agrin to MuSK requires an unidentified coreceptor (MASC) and results in tyrosine autophosphorylation of MuSK and activation of intracellular tyrosine kinases Src and Fyn. Activated MuSK recruits rapsyn, via an unidentified transmembrane protein, RAIL. Rapsyn, in turn, recruits ACh receptors, which become phosphorylated on tyrosine residues of the β subunit, and dystroglycan. Many additional postsynaptic components accumulate through interactions with dystroglycan (not shown).
Fig. 23.31. Interaction of Agrin with MuSK triggers differentiation of postsynaptic specializations in muscle cells at which ACh receptors, rapsyn, and dystroglycan accumulate. Binding of agrin to MuSK requires an unidentified coreceptor (MASC) and results in tyrosine autophosphorylation of MuSK and activation of intracellular tyrosine kinases Src and Fyn. Activated MuSK recruits rapsyn, via an unidentified transmembrane protein, RAIL. Rapsyn, in turn, recruits ACh receptors, which become phosphorylated on tyrosine residues of the β subunit, and dystroglycan. Many additional postsynaptic components accumulate through interactions with dystroglycan (not shown).
|
|
|
|
|
|
|


