 |
Задачи для контрольной работы
|
|
|
|
81-90. сделайте расчеты величин рН по данным в таблице концентрациям или величин концентраций вещества по данным в таблице величинам рН. Расчеты сделайте для всех столбцов таблицы, относящихся к вашему варианту. Коэффициент активности в растворах сильных электролитов = 1.
| № задачи | вещество | С, моль/л | С 
| С | рН | рОН |
| HCI NaOH | 10-2 | 10,5 | ||||
| HCI NaOH | 2,7 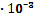
| |||||
| CH3COOH KOH | 5 
| 10-9 | ||||
| HNO3 NH4OH | 10-4 | 10-3 | ||||
| NaOH HCI | 10-4 | 4,89 | ||||
| CH3COOH KOH | 4,8 
| 10-5 | ||||
| HCI NaOH | 10-4 | 4,5 | ||||
| HNO2 KOH | 1,5 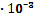
| 10-5 | ||||
| CH3COOH NaOH | 9,5 
| |||||
| NH4OH HCI | 10-3 | 10-12 |
91-92. почему буферные растворы препятствуют изменению рН раствора? Рассчитайте рН по данным таблицы (концентрации кислоты и соли одинаковы).
| № задачи | Буферная смесь | Количество кислоты, мл. | Количество соли, мл |
| CH3COOH CH3COONa | |||
| NaH2PO4 NaHPO4 |
93-95. Каково биологическое значение буферных смесей? Приведите примеры буферных растворов, встречающихся в живых организмах. Рассчитайте соотношение кислоты и соли (концентрации равные) в буферной смеси с величинами рН, представленными в таблице.
| № задачи | Буферная смесь | рН буферной смеси |
| KH2PO4 Na2HPO4 | 6,81 | |
| CH3COOH CH3COONa | 4,75 | |
| H2CO3 NaHCO3 | 7,3 |
Электропроводность растворов электролитов
Вопросы для самопроверки
1. Каковы различия между проводниками первого и второго рода? Приведите примеры таких проводников. Какова зависимость электропроводности таких проводников от температуры?
2. Что такое удельная электропроводность? Какие факторы на нее влияют? Как зависит удельная электропроводность от разбавления?
|
|
|
3. Что такое эквивалентная электропроводность? Какие факторы определяют ее значение? Как связана ее величина с разбавлением в растворах слабых электролитов?
4. Каковы различия зависимости эквивалентной электропроводности от разбавления в растворах сильных и слабых электролитов? От каких факторов зависит эквивалентная электропроводность при бесконечном разбавлении?
5. Дайте определение электрохимической подвижностью в водных растворах и почему?
6. Какое практическое значение имеет определение электропроводности? Как определяют влажность почв зерна?
7. Что такое кондуктометрическое титрование?
8. Почему в ходе нейтрализации кислоты щелочью электропроводность изменяется? Как она изменяется?
Решение типовой задачи
Вычислить степень и константу электролитической диссоциации 0,01 н раствора уксусной кислоты, эквивалентная электропроводность которого при 18  равна 1,47 см
равна 1,47 см  м2.
м2.
Решение. Эквивалентная электропроводность при данном разбавлении
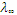 =
=  + +
+ +  -
-
где 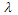 + и
+ и  - - электролитические подвижности аниона и катион диссоциирующей кислоты.
- - электролитические подвижности аниона и катион диссоциирующей кислоты.
СН3СООН 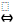 СН3СОО- + Н+
СН3СОО- + Н+
 + = 31,5
+ = 31,5
= 3,5
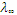 = + = 31,5+3,5=35,0
= + = 31,5+3,5=35,0
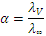 ,
, 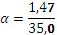 ,
, 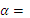 0,042.
0,042.
Согласно закону разбавления электролитической диссоциации слабого бинарного электролита К =, где – 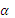 - степень электролитической диссоциации.
- степень электролитической диссоциации.
С – концентрация в молях на литр раствора.
К = 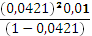 = 1,85
= 1,85 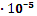 .
.
ЗАДАЧИ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ
96-98. как связана удельная электропроводность с эквивалентной электропроводностью? Что такое коэффициент электропроводности? Найти величину коэффициента электропроводности по данным таблицы (t = 25  ).
).
| № задачи | Электролит | Концентрация электролита | Удельная электропроводность Ом-1  см-1 см-1
|
| KCI | 0,1 н | 1,28  10-2 10-2
| |
| CH3COOH | 0,5 н | 325  10-4 10-4
| |
| NH4OH | 0,1 н | 3,32  10-4 10-4
|
99-101. Как методом электропроводности определяют константу и степень диссоциации слабых электролитов? Вычислите степень и константу диссоциации слабого электролита по данным таблицы.
|
|
|
| № задачи | Электролит | Концентрация электролита | Удельная электропроводность Ом-1  см-1 см-1
|
| CH3COOH | 0,01 | 14,3 | |
| NH4OH | 0,01 | 9,6 | |
| CH3COOH | 4,6 |
Электрохимия
Вопросы для самопроверки
1. Каковы возможные механизмы возникновения потенциалов на поверхности раздела фаз?
2. Что такое гальванический элемент? Какие скачки потенциалов имеются в гальваническом элементе? За счет каких процессов возникают эти скачки?
3. Схематически представьте медно-цинковый гальванический элемент. Какие процессы протекают на электродах при его работе?
4. Что такое диффузионный потенциал и почему он возникает? Какова его роль в гальваническом элементе?
5. Какими причинами может быть обусловлено возникновение скачка потенциала на границе раздела фаз? Обобщить на примерах возникновения скачков потенциалов в гальваническом элементе (в том числе и в мембранных электродах).
6. Определите электродвижущую силу медной концентрационной цепи при 18  , если концентрации ионов меди в растворах равны 1 г-ион/л и 0,1 г-ион/л. Коэффициенты активности в растворах этих концентраций соответственно равны f1=0,05 и f2 = 0,16.
, если концентрации ионов меди в растворах равны 1 г-ион/л и 0,1 г-ион/л. Коэффициенты активности в растворах этих концентраций соответственно равны f1=0,05 и f2 = 0,16.
7. 7. Перечислите мембранные электроды. КА возникает скачок потенциала на мембранном электроде? На биологической мембране?
8. Что такое окислительно – восстановительные потенциалы? Как и для чего определяют окислительно – восстановительные потенциалы почв?
Решение типовой задачи
Гальванический элемент состоит из медного и цинкового электродов. Приведите выражение для расчета ЭДС такого элемента с учетом концентраций ионов Cu2+ и Zn2+. Рассчитайте концентрацию ионов Cu2+ в гальваническом элементе, величина ЭДС которого равна 1,04 В, а концентрация ионов Zn2+ равна 0,1 моль/л (10-1 моль/л).
Решение. ЭДС элемента равна разности электродных потенциалов Е = 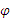 Сu –
Сu – 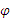 Zn.
Zn.
Схема записи элемента:
Cu 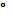 .
.
На электродах протекают процессы:
Cu2+ + 2 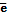 = Cu
= Cu 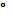 , Zn - 2
, Zn - 2 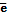 = Zn2+..
= Zn2+..
катод анод
Уравнения электродных потенциалов:
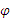 Cu=
Cu= 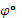 Сu+0,059 lg,
Сu+0,059 lg, 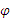 Zn=
Zn= 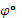 Zn+0,059 lg,
Zn+0,059 lg,
Итак, ЭДС = 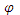 Cu -
Cu - 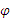 Zn=
Zn= 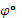 Сu + 0,059 lg
Сu + 0,059 lg 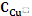 -
- 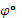 Zn-0,059 lg
Zn-0,059 lg 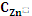 =
= 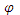 Cu -
Cu - 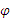 Zn+0,059(lg
Zn+0,059(lg 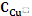 -lg
-lg 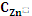 ).
).
Величины 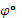 Сu и
Сu и 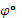 Zn табличные, они равны соответственно +0,34 В и -0,76 В, так что
Zn табличные, они равны соответственно +0,34 В и -0,76 В, так что
|
|
|
ЭДС = +0,34 – ((-0,76)+0,059 (lg 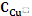 -lg
-lg 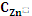 )).
)).
ЭДС= 1,1+0,059(lg 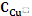 -lg
-lg 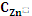 ).
).
Выполнена первая часть задачи.
Найдем теперь значение 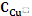 ; из уравнения для ЭДС имеем:
; из уравнения для ЭДС имеем:
lgCCu= 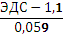 +lg CZn
+lg CZn
Подставим данные в задаче величины ЭДС и CZn.
lg CCu= 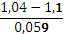 +lg
+lg 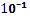 =
= 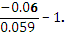
Так как 0,06  0,059, значит, lgCCu= -1-1=-2.
0,059, значит, lgCCu= -1-1=-2.
Следовательно, CCu= 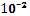 моль/л=0,01 моль/л.
моль/л=0,01 моль/л.
|
|
|


