 |
Ситуационные задачи для контроля усвоения темы
|
|
|
|
1. В пробирке находится смесь 0,1 М растворов: хлорида натрия, бромида калия и йодида калия. Постепенно по каплям к этой смеси добавляют 0,1% раствор нитрата серебра. В какой последовательности будут выпадать в осадок соли? Ответ объяснить пользуясь величинами ПР соответствующих солей.
2. Возможен ли перевод PbSO4 в PbS? В чем визуально это выражается? Возможен ли перевод PbS в PbSO4?
3. В растворе имеются фосфат- и хлорид- ионы. При введении какого катиона будут наблюдаться: а) выпадение в осадок только одного иона; б) выпадение в осадок обоих ионов?
4. В растворе имеются ионы магния и кальция. При введении какого аниона в системе будет наблюдаться: а) изолированное гетерогенное равновесие; б) совмещенное гетерогенное равновесие? Какой из двух конкурирующих процессов будет преобладать в случае (б)?
5. К насыщенному водном раствору SrSO4 добавили: а) раствор Ca(NO3)2; б) раствор Ba(NO3)2. Опишите возможные изменения в обоих случаях и объясните их.
6. Сколько грамм ионов Ag+ находится в 10 л насыщенного раствора AgBr (ПР=5,3×10-13).
7. Раствор карбоната калия с концентрацией 0,001 М находится в контакте с осадком карбоната кальция. Чему равна концентрация ионов кальция в жидкости над осадком? Вычислите массу кальция, находящегося в виде ионов в 0,5 л такой жидкости (ПР  = 3,8×10-9).
= 3,8×10-9).
8. Раствор ацетата кальция приготовили смешением соли массой 1 г с водой 350 мл. Этот раствор смешали с раствором сульфата натрия с концентрацией 0,025 моль/л, причем объемы смешиваемых растворов были равны между собой. Образуется ли осадок в этих условиях? (ПР 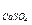 = 2,5×10-5)
= 2,5×10-5)
9. Смешали 100 мл 2%-ного раствора K2SO4 (r=1,02) и 150 мл 5%-ного раствора Pb(NO3)2 (r=1,04). Выпадет ли осадок? (ПР 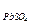 = 1,6×10-8)
= 1,6×10-8)
10. При какой концентрации СО  -ионов образуется осадок из 0,5 моль/л раствора Ca(NO3)2? (ПР
-ионов образуется осадок из 0,5 моль/л раствора Ca(NO3)2? (ПР  = 3,8×10-9).
= 3,8×10-9).
|
|
|
11. Вычислите массу Pb(NO3)2, которую надо добавить к водному раствору Na2CO3 с концентрацией 0,01 моль/л объемом 200 мл, чтобы получить осадок (ПР 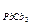 = 7,5×10-14).
= 7,5×10-14).
12. Какой концентрации ионов Ва2+ следует достичь, чтобы из насыщенного водного раствора СаSO4 выпал осадок ВаSO2? (ПР 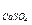 = 2,5×10-5, ПР
= 2,5×10-5, ПР  = 1,1×10-10)
= 1,1×10-10)
Домашнее задание
Тема: «Комплексные соединения и лигандообменные равновесия».
Литература: [1] с. 191; [3] с. 174; [4] с. 72.
Дополнительная:
1. Лекционный материал.
2. Ахметов Н.С. Общая и неорганическая химия. –М., Высшая школа, 2002.
3. Неорганическая биохимия. Под ред. Г. Эйхгорна. М., Мир, 1978. т. 1 и 2.
ЗАНЯТИЕ №16
Тема: Комплексные соединения и лигандообменные равновесия.
Актуальность темы: Практически все ионы d-элементов в условиях организма находятся в связанном состоянии, т.к. образуют комплексные соединения с различными биолигандами, в состав которых входят донорные атомы кислорода, азота, серы. Биокомплексные соединения значительно различаются по своей устойчивости. Одни из них настолько прочны, что постоянно находятся в организме и выполняют определенную функцию. Роль металла в таких комплексах высокоспецифична; замена его даже на близкий по физико-химическим параметрам металл приводит к значительной или полной утрате физиологической активности. Примерами таких соединений является гемоглобин (только кобальтовый аналог этого соединения обладает незначительной способностью связывать и переносить кислород); витамин В-12, хлорофилл. С другой стороны, в организме есть весьма непрочные комплексные соединения, которые часто образуются только на то время, которое нужно для выполнения определенных функций (например, образование между ионом металла - активатором и ферментом комплексного соединения на период осуществления катализа). Специфичность металла таких комплексов часто не ярко выражена, он может быть заменен на другой без потери физиологической активности.
|
|
|
К биокомплексам с невысокими значениями констант устойчивости можно отнести и такие, которые стабилизируют сложные структуры. Например, образование металлополинуклеотидных комплексов стабилизирует двойную спираль ДНК.
В живых организмах найдено много ферментов, в состав которых входят ионы металлов. Для организма характерно не только протолитический и ионный гомеостаз, но также поддержание на постоянном уровне и концентрации веществ лигандообменных равновесий. Нарушение металлолигандного гомеостаза приводит к различным патологиям. В таких случаях организм включает защитные механизмы и со временем возвращает основные показатели к норме. Однако в ряде случаев возникает необходимость в проведении фармакотерапии.
Учебные цели: сформировать системные знания по теории равновесий комплексообразования для обоснования протекающих в условиях живых организмов образования и разрушения биокомплексных соединений и поддержания металлолигандного гомеостаза.
В результате освоения темы студент должен уметь:
· Различать простые и комплексные соединения;
· Написать по названию и называть по формулам комплексные соединения;
· Писать уравнения реакции образования комплексных соединений по реакциям внедрения и присоединения;
· Писать уравнения реакции диссоциации комплексных соединений и выражать константы устойчивости или нестойкости комплексного иона;
· Определять валентность (или степень окисления) и координационное число комплексообразователя и заряд комплексного иона, дентантность лигандов;
· Предсказывать комплексообразующую способность металлов и неметаллов на основе электронного строения их атомов;
· Оценивать прочность комплексных соединений на основании их констант устойчивости или нестойкости.
Для формирования умений студент должен знать:
· Сущность координационной теории А. Вернера;
· Понятия: комплексообразователь (центральный атом), лиганды (адденды), координационное число, дентантность лиганда;
· Классификацию комплексных соединений по заряду комплексного иона и по природе лиганда;
|
|
|
· Современную номенклатуру комплексных соединений;
· Типы гибридизации комплексообразователя и геометрическую форму комплексных ионов;
· Изомерию комплексных соединений;
· Биологическую роль важнейших биокомплексов и применение комплексообразования в медицине.
Вид занятий: лабораторно-практическое.
Продолжительность занятия: 3 академических часа.
Оснащение рабочего места: штатив с пробирками, мерные пробирки, пипетки, фильтровальная бумаги, стеклянная палочка, таблица с константами устойчивости и нестойкости комплексных соединений, калькуляторы.
Реактивы: 0,1 М растворы CuSO4, Bi(NO3)3, KJ, KOH, NaCl, FeCl3, H2C2O4, KCNS, HNO3, H2SO4; 10% раствор NH3; 0,1% растворы AgNO3 и KMnO4; сухие соли K4[Fe(CN)6] и FeSO4; металлический Zn.
Содержание занятия
1. Контроль исходного уровня знаний (тест).
2. Разбор теоретических вопросов и решение ситуационных задач.
3. Выполнение лабораторной работы:
а) получение комплексных соединений;
б) диссоциация и разрушение комплексных ионов;
в) изучение окислительно-восстановительных свойств комплексных ионов.
4. Выходной контроль знаний. Проверка протоколов лабораторных работ.
5. Подведение итогов занятия. Задание на дом по теме: «Электрохимические методы исследования. Потенциометрия».
Вопросы и задачи для подготовки к занятию
1. В чем различие простых и комплексных соединений?
2. В чем сущность координационной теории А. Вернера чем сущность координационной теореии А. ненийных ионовкомплексообразования в медицинеивости или нестойкости комплексного иона;?
3. Классификация комплексных соединений: а) по заряду комплексного иона, б) по природе лиганда.
4. Внутрикомплексное соединения (хелаты).
5. Константы устойчивости и нестойкости комплексных соединений. Связь между ними.
6. Лигандообменные процессы в жизнедеятельности и их значение.
7. Понятие о металло-лигандном гомеостазе.
8. Понятие о хелатотерапии и ее применение.
9. Приведите примеры биокомплексных соединений, содержащих железо, кобальт, цинк.
10. Напишите формулы следующих комплексных соединений: гексанитрокобальтат (III) натрия; хлорид гексаамминникеля (II); дибромодихлороаурат (III) кальция; сульфат бромопентааминкобальта (III); хлорид дихлородиамминплатины (IV).
|
|
|
11. Возможно ли в стандартном состоянии замещение лигандов: а) в тетрацианоцинканат-ионе на аммиак; б) в динитроаргентат-ионе на цианид-ион; в гексацианоферрат (III)-ионе на фторид-ион? Ответ подтвердите, пользуясь справочными данными.
12. Вычислите концентрации иона цинка в растворе тетрацианоцинката натрия с концентрацией 0,01 моль/л, если цианид-ионы имеют концентрацию 0,3 моль/л, а константа нестойкости комплекса равна 2,4×10-20.
13. Напишите уравнения диссоциации комплексных соединений: K3[Co(NO2)6]; [Ni(NH3)6]SO4; [Co(NH3)4Cl2]SO4; Mg[Pt(CN)4]. Приведите выражения полных констант нестойкости комплексных ионов.
14. Константа нестойкости комплексного иона [Ag(NH3)2]+ равна 6×10-8. Рассчитайте концентрацию ионов комплексообразователя в 0,001 М растворе.
15. Пригототвлен раствор объемом 1 л смешением воды с 0,2 моль нитрата серебра и 0,5 моль аммиака. Вычислите концентрацию ионов серебра в этом растворе, если kнест комплекса равен 6×10-8.
Литература:
[1] с. 191; [3] с. 174; [4] с. 72.
Дополнительная:
1. Ахметов Н.С. Общая и неорганическая химия. М., Высшая школа, 2002.
2. Неорганическая биохимия. Под ред. Г. Эйхгорна. М., Мир, 1978. т.1 и 2.
|
|
|


