 |
Ситуационные задачи для контроля усвоения темы
|
|
|
|
1. Напишите формулы следующих комплексных соединений: гексанитрокобальтат (III) калия; бромид гексаамминникеля (II); дибромодихлороаурат (III) магния; хлорид этилендиаминплатины (II); динитродиамминкобальт (II) калия.
2. Назвать следующие комплексные соединения: [Pd(H2O)(NH3)2Cl]Cl; [Co(NH3)5SO4]NO3; K2[Co(NH3)2(NO2)4]; K2[Pt(OH)5Cl]; [Cu(NH3)2(CNS)2]; [Pt(NH3)2Cl4].
3. Установите (пользуясь константами нестойкости комплексов), в каких случаях произойдет взаимодействие между растворами электролитов:
· K[Ag(CN)2] + NH3 ®
· [Ag(NH3)2]Cl + K2S2O3 ®
· K2[HgJ4] + KCN ®
4. Вычислите концентрацию иона цинка в растворе тетрацианоцинката натрия с концентрацией 0,1 моль/л при избытке цианид-ионов, равном 0,3 моль/л, если константа нестойкости комплекса равна 2,4×20-20.
5. Вычислите массу серебра, содержащегося в виде ионов в растворе хлорида диамминсеребра (I) с концентрацией 0,01 моль/л объемом500 мл. Раствор содержит аммиак, концентрация которого 0,1 моль/л, kнест[Ag(NH3)2]+=9,3×10-8.
6. Константы нестойкости комплексных ионов [Zn(NH3)4]2+ и [Zn(CN)4]2- составляют: 2×10-9 и 1×10-19. В каком из комплексов концентрация ионов Zn2+ больше, если комплексные ионы имеют одинаковую концентрацию – 0,001 моль/л?
7. Вычислите концентрацию иона ртути (II) в растворе тетраамминртути с концентрацией 0,1 моль/л при избытке NH3, равном 0,5 моль/л и kнест[Hg(NH3)4]2+=5×10-20.
8. Во сколько раз уменьшается концентрация ионов кадмия в растворе нитрата кадмия с концентрацией 0,1 моль/л после введения 0,4 моль/л аммиака (kнест[Cd(NH3)4]2+ = 2,8×10-7)?
9. Рассчитайте массу золота, находящегося в виде ионов в 100 мл раствора дицианоаурата (I) калия с концентрацией 0,01 моль/л при избытке цианида калия, равном 0,1 моль/л (kнест[Au(CN)2]-=5×10-30).
10. При какой концентрации Na2S начнет выпадать осадок из раствора тетрацианокадмиата (II) калия с концентрацией 0,1 моль/л, содержащего избыток цианид-ионов, равный 0,5 моль/л? kнест[Cd(CN)4]2- = 7,8×10-18; ПРCdS = 8×10-27.
|
|
|
Домашнее задание
Тема: «Электрохимические методы исследования. Потенциометрия».
Литература: [1] с. 464; [3] с. 156; [4] с. 85.
Дополнительная:
1. Пономарев В.Д. Аналитическая химия. Кн.2. М., Высшая школа. 1982.
2. Харитонов Ю.Я. Аналитическая химия. Аналитика. Кн.2. М., Высшая школа. 2002.
ЗАНЯТИЕ №17
Тема: Электрохимические методы исследования. Потенциометрия.
Актуальность темы: Из электрохимических методов исследования в медицине и биологии наиболее часто применяются методы потенциометрии. Потенциометрия – незаменимый во многих случаях метод определения физиологически активных ионов (H3O+, Na+, Ca2+, NH  , K+, Cl-, Br-, J- и др.) в биологических жидкостях (крови, спинномозговой жидкости, моче и др.) и тканях организма. Миниатюрные ионселективные электроды позволяют проводить исследования на клеточном уровне.
, K+, Cl-, Br-, J- и др.) в биологических жидкостях (крови, спинномозговой жидкости, моче и др.) и тканях организма. Миниатюрные ионселективные электроды позволяют проводить исследования на клеточном уровне.
Потенциометрический метод определения рН по сравнению с колориметрическим методом является более точным и надежным. Он используется и в тех случаях, когда колориметрические методы неприемлемы (окрашенные и мутные среды: кровь, суспензии бактериальных клеток; системы, содержащие агрессивные по отношению к индикаторам вещества). Эти достоинства потенциометрического метода измерения рН обусловили его широкое применение в биохимических, клинических и санитарно-гигиенических лабораториях.
Потенциометрическое титрование используется для определения концентрации биологически активных и лекарственных веществ в биологических объектах.
Учебные цели: сформировать системные знания о возникновении электродных потенциалов и их измерении; ознакомить измерением рН потенциометрическим методом.
В результате освоения темы студент должен уметь:
|
|
|
· Рассчитывать электродные и окислительно-восстановительные потенциалы по уравнениям Нернста и Нернста-Петерса;
· Правильно записывать гальванические цепи;
· Уметь измерять и рассчитывать ЭДС гальванических элементов;
· Подбирать соответствующие электроды для потенциометрических измерений;
· Электрометрически определять рН растворов.
Для формирования умений студент должен знать:
· Механизм возникновения электродного и окислительно-восстановительного потенциалов;
· Уравнения Нернста и Нернста-Петерса для расчета потенциалов;
· Гальванические элементы и правила их составления;
· Различные типы электродов, применяемые в потенциометрических измерениях;
· Редокс-процессы, протекающие в живых системах;
· Методы прямой потенциометрии и потенциометрического титрования.
Вид занятий: лабораторно-практическое.
Продолжительность занятия: 3 академических часа.
Оснащение рабочего места: электроды: стеклянный и хлорсеребряный, рН-метр (рН-150 МИ), штатив со стаканом, инструкция по работе с рН-метром, калькуляторы, справочные таблицы со стандартными значениями потенциалов, фильтровальная бумага.
Реактивы: буферные растворы с известными значениями рН, исследуемые растворы с неизвестными значениями рН, дистиллированная вода.
Содержание занятия
1. Контроль исходного уровня знаний (тест).
2. Разбор теоретических вопросов и решение ситуационных задач.
3. Разбор и выполнение лабораторной работы: Измерение рН потенциометрическим способом.
4. Выходной контроль знаний и умений студентов. Решение ситуационных задач.
5. Подведение итогов занятия. Проверка протокола лабораторной работы.
6. Задание на дом: «Рубежная контрольная работа по IV блоку».
Вопросы и задачи для подготовки к занятию
1. Что называют редокс-системой? Приведите примеры двух разных редокс-систем, в состав которых входят: а) Fe2+; б) NO 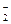 ; в) Н2О2.
; в) Н2О2.
2. Что называют стандартным и формальным редокс-потенциалом?
3. Какие факторы влияют на величину редокс-потенциала?
4. Объясните, почему нитрат-ион не окисляет ион Fe(II) в растворе с рН=7, но окисляет в растворе с рН=1.
5. Приведите примеры редокс-процессов в живых системах, сопровождающихся изменением степени окисления d-элементов.
|
|
|
6. Приведите примеры измерительных электродов, используемых для: а) потенциометрического определения рН; б) определения концентраций ионов кальция в крови.
7. Какие требования предъявляются к электродам сравнения? Приведите примеры двух электродов сравнения.
8. Приведите схему гальванического элемента, составленного для измерения рН.
9. Опишите устройство стеклянного электрода.
10. Как практически определяют величину редокс-потенциала?
11. Какие процессы происходят на электродах гальванического элемента: Zn/Zn2+//Cu2+/Cu0, если  =1 моль/л? В каком направлении перемещаются электроны во внешней цепи?
=1 моль/л? В каком направлении перемещаются электроны во внешней цепи?
12. Вычислите рН слюны, если потенциал водородного электрода при 298о К равен -372 мВ.
Литература:
[1] с. 464; [3] с. 156; [4] с. 85.
Дополнительная:
1. Харитонов Ю.Я. Аналитическая химия. Аналитика. Кн. 1 и 2. М., Высшая школа, 2002.
2. Лекция по теме «Электрохимия».
|
|
|


