 |
Ситуационные задачи для контроля усвоения темы
|
|
|
|
1. Пользуясь таблицей стандартных потенциалов составьте схемы двух гальванических элементов в одном из которых медь служила бы катодом, а в другом – анодом. Напишите уравнения реакций, происходящих при работе этих элементов и вычислите значения стандартных ЭДС.
2. Вычислить потенциал водородного электрода, погруженного:
а) в чистую воду;
б) в раствор с рН=3,5;
в) в раствор с рН=10,7.
3. ЭДС гальванического элемента, составленного из двух водородных электродов, равна 273 мВ. Чему равен рН раствора, в котором погружен анод, если катод погружен в раствор с рН=3?
4. Определите, возможна ли реакция между KMnO4 и KBr в растворе с рН=2, если концентрации равны: калия перманганата 0,01 моль/л, MnSO4 – 0,001 моль/л, бромид-иона и брома по 0,01 моль/л. Т=298о К.
5. Концентрации лактат- и пируват- ионов в буферном растворе (рН=7) равны между собой. Как изменится потенциал при окислении 1/10 части лактат- ионов до пируват- ионов?
6. Гальванический элемент составлен из двух водородных электродов, погруженных в растворы ацетата натрия и хлорида аммония с концентрациями по 1,0 моль/л. Вычислите ЭДС цепи при 298о К.
7. Вычислите при 310о К потенциал водородного электрода погруженного в слюну с рН=6,3. Давление газообразного водорода равно 101,3 кПа.
8. Вычислите стандартное значение ЭДС при 25о С гальванического элемента, составленного из серебряного и хлорсеребряного электродов. Какой процесс протекает на аноде?
9. Для измерения рН крови составлена гальваническая цепь из нормального каломельного и водородного электродов. Вычислите диапазон возможных значений ЭДС составленной цепи (Т=310о К).
10. Для измерения рН слезной жидкости была составлена гальваническая цепь из водородного и насыщенного хлорсеребряного электродов. Измеренная при 25о С ЭДС составила 0,705 В. Вычислите рН слезной жидкости.
|
|
|
Домашнее задание
Тема: «Рубежная контрольная работа по блоку IV».
Литература: [1] с. 129, 191, 484; [3] с. 125, 156, 174; [4] с. 60, 72, 85.
Дополнительная:
1. Лекционный материал.
2. Ахметов Н.С. Общая и неорганическая химия. М., Высшая школа. 2002.
3. Харитонов Ю.Я. Аналитическая химия. Аналитика. Кн. 1 и 2. М., Высшая школа. 2002.
4. Неорганическая биохимия. т. 1 и 2. Под ред. Г. Эйхгорна. М., Мир. 1978.
ЗАНЯТИЕ №18
Тема: Рубежная контрольная работа по IV блоку.
Учебные цели: проверка усвоения материала по данному блоку.
Вид занятий: практическое.
Продолжительность занятия: 3 академических часа.
Оснащение рабочего места: справочники, калькуляторы, таблицы.
Содержание занятия
1. Решение ситуационных и расчетных задач.
2. Ответы на теоретические вопросы.
3. Защита одной из лабораторных работ
4. Подведение итогов занятия. Задание на дом: «Подготовка к итоговому тестированию».
Вопросы к рубежной контрольной работе по IV блоку
1. Укажите термодинамические и кинетические условия равновесия в системе твердое вещество – его насыщенный раствор.
2. Сформулируйте правило произведения растворимости. Из какого закона оно вытекает?
3. Приведите математическое выражение правила произведения растворимости для следующих электролитов: AgBr, PbCl2, Ca3(PO4)2 и AxBy.
4. По каким формулам можно рассчитать растворимость следующих электролитов: BaSO4, Ag2CrO4, BiJ3, Ca3(PO4)2 и АхВу?
5. Какие следствия вытекают из правила произведения растворимости? Сформулируйте их.
6. Как влияют присутствие одноименного иона на растворимость осадка? Приведите конкретный пример.
7. Приведите общую схему и конкретный пример, иллюстрирующие 2 конкурирующие гетерогенные процессы: конкуренция за анион и конкуренция за катион.
8. При каких условиях одно малорастворимое соединение переходит в другое малорастворимое соединение?
|
|
|
9. При каких случаях на растворимость труднорастворимого соединения оказывает влияние рН среды? Покажите на примерах и объясните это явление.
10. Влияет ли природа растворителя, температура и посторонние вещества на растворимость труднорастворимого электролита? Чем это объясняется?
11. Приведите примеры гетерогенных процессов, протекающих в живых системах при норме и патологии.
12. Как объяснить, почему радионуклид стронция-90 легко включается в состав костной ткани? Чем это опасно для организма?
13. В растворе имеются ионы Pb2+ и Ва2+. При введении какого аниона в системе будет наблюдаться: а) изолированное гетерогенное равновесие, б) совмещенное гетерогенное равновесие? Какой из двух конкурирующих процессов будет преобладать в случае (б)?
14. К насыщенному водному раствору AgBr добавили: а) раствор NaCl; б) раствор KJ. Опишите возможные изменения в обоих случаях.
15. В чем различие простых и комплексных соединений?
16. В чем сущность координационной теории А. Вернера чем сущность координационной теореии А. ненийных ионовкомплексообразования в медицинеивости или нестойкости комплексного иона;?
17. Классификация комплексных соединений: а) по заряду комплексного иона, б) по природе лиганда.
18. Внутрикомплексное соединения (хелаты).
19. Константы устойчивости и нестойкости комплексных соединений. Связь между ними.
20. Лигандообменные процессы в жизнедеятельности и их значение.
21. Понятие о металло-лигандном гомеостазе.
22. Понятие о хелатотерапии и ее применение.
23. Приведите примеры биокомплексных соединений, содержащих железо, кобальт, цинк.
24. Напишите формулы следующих комплексных соединений: гексанитрокобальтат (III) натрия; хлорид гексаамминникеля (II); дибромодихлороаурат (III) кальция; сульфат бромопентааминкобальта (III); хлорид дихлородиамминплатины (IV).
25. Возможно ли в стандартном состоянии замещение лигандов: а) в тетрацианоцинканат-ионе на аммиак; б) в динитроаргентат-ионе на цианид-ион; в гексацианоферрат (III)-ионе на фторид-ион? Ответ подтвердите, пользуясь справочными данными.
26. Напишите уравнения диссоциации комплексных соединений: K3[Co(NO2)6]; [Ni(NH3)6]SO4; [Co(NH3)4Cl2]SO4; Mg[Pt(CN)4]. Приведите выражения полных констант нестойкости комплексных ионов.
|
|
|
27. Что называют редокс-системой? Приведите примеры двух разных редокс-систем, в состав которых входят: а) Fe2+; б) NO 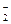 ; в) Н2О2.
; в) Н2О2.
28. Что называют стандартным и формальным редокс-потенциалом?
29. Какие факторы влияют на величину редокс-потенциала?
30. Объясните, почему нитрат-ион не окисляет ион Fe(II) в растворе с рН=7, но окисляет в растворе с рН=1.
31. Приведите примеры редокс-процессов в живых системах, сопровождающихся изменением степени окисления d-элементов.
32. Приведите примеры измерительных электродов, используемых для: а) потенциометрического определения рН; б) определения концентраций ионов кальция в крови.
33. Какие требования предъявляются к электродам сравнения? Приведите примеры двух электродов сравнения.
34. Приведите схему гальванического элемента составленного для измерения рН.
35. Опишите устройство стеклянного электрода.
36. Как практически определяют величину редокс-потенциала?
37. Какие процессы происходят на электродах гальванического элемента: Zn/Zn2+//Cu2+/Cu0, если  =1 моль/л? В каком направлении перемещаются электроны во внешней цепи?
=1 моль/л? В каком направлении перемещаются электроны во внешней цепи?
|
|
|


