 |
Опыт 5. Переосаждение малорастворимых веществ
|
|
|
|
А. Получение сульфида свинца из сульфата свинца. В пробирку внести 2 капли раствора нитрата свинца и прибавить туда же 3 капли раствора сульфата натрия. Осадок какого вещества образовался? Написать ионное уравнение реакции.
Осадку дать отстояться и кусочком фильтровальной бумаги или пипеткой отобрать жидкую фазу. К осадку добавить 3–4 капли сульфида аммония и перемешать осадок стеклянной палочкой. Как изменился цвет осадка? Какое вещество образовалось? Написать выражения произведений растворимости и их численные значения для полученных малорастворимых веществ. Объяснить переход одного осадка в другой.
Б. Получение хромата свинца из сульфата свинца. Получить сульфат свинца: в пробирку внести 2 капли раствора нитрата свинца и прибавить туда же 3 капли раствора сульфата натрия. Перевести его в хромат свинца: осадку дать отстояться и кусочком фильтровальной бумаги или пипеткой отобрать жидкую фазу, к осадку добавить 3–4 капли хромата калия. Как изменился цвет осадка?
Написать уравнения протекающих реакций. Записать величины произведений растворимости полученных, малорастворимых веществ и объяснить переход сульфата свинца в хромат свинца.
Опыт 6. Образование нерастворимых гидроксидов металлов (рН гидратообразования). В пять пробирок отобрать по 10 капель растворов солей железа (III), меди, железа (II), магния, кальция. В каждую пробирку добавлять по каплям 0,2 н. раствор NaOH до появления осадка гидроксида. В каждом случае записать число капель добавленного раствора щелочи:
| № пробирки | Формула соли | Число капель щелочи до образования осадка гидроксида | Формула гидроксида | Произведение растворимости |
| Fe(OH)3 | 6,3×10-38 | |||
| Cu(OH)2 | 2,2×10-20 | |||
| Fe(OH)2 | 8×10-16 | |||
| Mg(OH)2 | 6,0×10-10 | |||
| Ca(OH)2 | 5,5×10-6 |
|
|
|
Составить уравнения реакций образования гидроксидов металлов. Как связано количество добавленной щелочи и произведение растворимости гидроксида металла? Оценить рН гидратообразования в каждом случае.
Протокол лабораторной работы
По каждому опыту записать используемые при проведении эксперимента реактивы и результаты проведения реакций.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Уравнения реакций в молекулярной и ионной форме, результаты проведения реакций, заполненные таблицы и.т.п.
4. Ответы на вопросы по каждому опыту.
5. Выводы.
Лабораторная работа № 9. Исследование окислительно-восстановительных реакций
Цель работы: познакомиться с наиболее распространенными окислителями и восстановителями, с продуктами их взаимодействия между собой и научиться составлять уравнения окислительно-восстановительных реакций.
Общие сведения
Окислительно-восстановительными называют реакции, протекающие с изменением степени окисления элементов.
Степень окисления – это гипотетический заряд, который был бы на атомах данного элемента, если бы соединение было построено из ионов.
Высшая степень окисления элемента равна номеру группы периодической системы, в которой данный элемент расположен. Низшая отрицательная степень окисления равна числу электронов, которое может принять данный элемент на застраивающийся np -подуровень: z min = N – 8, где N – номер группы. Например, у серы высшая степень окисления равна 6, а низшая: 6 – 8 = −2. В простых веществах степень окисления равна нулю. Многие элементы проявляют в соединениях постоянные значения степени окисления: фтор −1; кислород −2, кроме пероксидов, в которых степень окисления кислорода −1; щелочные металлы +1; щелочноземельные металлы +2; водород, кроме гидридов и органических соединений, +1.
|
|
|
Степени окисления переменновалентных элементов рассчитывают по правилу баланса зарядов: «сумма степеней окисления всех элементов в соединении равна нулю, а в многоатомном ионе – заряду иона».
Например, в дихромате калия K2Cr2O7 согласно балансу зарядов 2 z K + 2zCr + 7 z O = 0, следовательно, подставив z K = 1 и z O = −2, получаем z Cr = +6; в перманганат-ионе 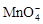 z Mn + 4 z O = −1, следовательно, z Mn = +7.
z Mn + 4 z O = −1, следовательно, z Mn = +7.
Окислителем называют элемент, который в ходе реакции понижает степень окисления, а восстановителем – элемент, который повышает степень окисления. Окислитель при этом принимает электроны на валентную оболочку, а восстановитель отдает электроны.
Правила составления уравнений окислительно-восстановительных реакций следующие. Возьмем в качестве примера восстановление перманганата нитритом калия в нейтральной среде:
KMnO4 + KNO2 + H2O = ¼
Определяют степени окисления переменновалентных элементов, окислитель и восстановитель. Калий, кислород и водород имеют постоянные значения степеней окисления, указанные выше. По балансам зарядов вычисляем z Mn = +7, z N = +3. Поскольку марганец в высшей степени окисления, равной номеру группы, он является окислителем. Азот может повысить степень окисления до номера группы +5, поэтому он является восстановителем.
Составляют ионные уравнения полуреакций окисления и восстановления. Для уравнивания числа атомов кислорода добавляют воду и ионы: H+ в кислой среде или ОН- в щелочной среде.
Восстановление: 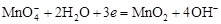 .
.
Окисление: 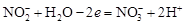 .
.
Приводят число электронов к наименьшему общему кратному, в примере к 6. Для этого уравнения полуреакций домножают на соответствующие коэффициенты, в примере на 2 и 3. Суммируют уравнения полуреакций, сокращая одинаковые члены в левой и правой частях и учитывая нейтрализацию Н+ + ОН- = Н2О. В результате получают ионное уравнение реакции:
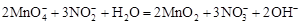 .
.
Составляют молекулярное уравнение реакции путем добавления к ионам имеющихся в растворе противоионов:
2KMnO4 + 3KNO2 + H2O = 2MnO2 + 3KNO3 + 2KOH.
Глубина восстановления перманганата зависит от кислотности среды. В кислой среде перманганат восстанавливается до степени окисления +2 согласно полуреакции:
|
|
|
 .
.
В нейтральной среде, ввиду недостатка ионов Н+, восстановление идет до MnO2 по приведенной в примере полуреакции. В щелочной среде восстановление заканчивается уже на стадии образования Mn(6+) в форме манганат-иона 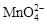 . Уравнение полуреакции:
. Уравнение полуреакции:
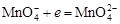 .
.
От кислотности среды зависит также состояние в растворе хрома (VI) вследствие протекания реакций:
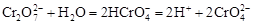 .
.
Cогласно принципу Ле-Шателье, в кислой среде, при избытке ионов Н+, равновесие смещается влево, и хром находится в растворе в форме оранжевого дихромата. В щелочной среде, когда ионы Н+ в недостатке, равновесие смещено вправо, и хром переходит в форму желтого хромата. Окислительная способность хрома (VI) выше в кислой среде. Дихромат – сильный окислитель, восстанавливающийся по полуреакции:
 .
.
Хромат – слабый окислитель, поэтому хром (VI) получают обычно окислением хрома (3+) в щелочной среде по полуреакции:
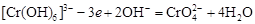 .
.
Контрольные вопросы
1. Какие реакции называют окислительно-восстановительными?
2. В каком случае элемент является окислителем?
3. В каком случае элемент является восстановителем?
4. Что такое степень окисления?
5. Чему равна максимальная степень окисления элемента?
6. Как определить минимальную степень окисления элемента?
7. Как определить степень окисления соединения в соединении?
8. Как зависит состав продуктов восстановления перманганата калия в зависимости от рН среды?
9. Как зависит состав продуктов восстановления хрома (VI) от рН среды?
10. В какой степени окисления элементы обладают окислительно-восстановительной двойственностью?
Оборудование и реактивы
В штативе: иодид калия, бромид калия, перманганат калия, хлорид бария, нитрат калия, сульфат хрома (III), бихромат калия, сульфат марганца (II), роданид аммония, гидроксид натрия, гидроксид калия, йод – растворы концентрацией 5 %. В вытяжном шкафу: серная кислота – 2 н. раствор, серная кислота - раствор концентрацией 20 %, соляная кислота – раствор концентрацией 15 %, соляная кислота – концентрированный раствор, азотная кислота – 15 % раствор, азотная кислота – концентрированный раствор, хлорная вода, бромная вода, сероводород – раствор, сульфид натрия – раствор концентрацией 5 %, сернистая кислота. Получать в лаборантской: пробирки – 5 шт.; перекись водорода – концентрированный раствор; ССl4; крахмал, сульфит натрия, нитрит натрия, хлорид олова (II), хлорид олова (IV), сульфат железа (II), гесацианоферрат (III) калия – растворы концентрацией 5 %; медь металлическая, сера – порошок, уголь, оксид свинца (IV) – порошок, оксид марганца (IV).
|
|
|
Выполнение работы
Для всех реакций, выполняемых в ходе работы, необходимо составить уравнения полуреакций окисления и восстановления, а также полные ионные и молекулярные уравнения.
Опыт 1. Окислительные свойства пероксида водорода. Налить в пробирку 3−4 капли раствора пероксида водорода, добавить 2−3 капли 2 н. раствора серной кислоты и столько же раствора иодида калия. К содержимому пробирки добавить крахмал. Обратить внимание на окраску раствора.
|
|
|


