 |
Обработка результатов эксперимента
|
|
|
|
1. Вычислить экспериментальное значение буферной емкости:
 , моль/л,
, моль/л,
где С Т и V Т – концентрация и эквивалентный объем титранта, а Va – аликвотный объем буферного раствора, отобранный мерной пипеткой для титрования.
2. Рассчитать теоретическое значение буферной емкости.
Для ацетатного буфера вычислить буферную емкость по щелочи:
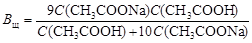 ,
,
где С (CH3COONa) и C (CH3COOH) – концентрация соли и кислоты в полученном буферном растворе, моль/л.
Для аммиачно-хлоридного буфера вычислить буферную емкость по кислоте:
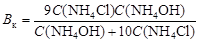 ,
,
где С (NH4OH) и C (NH4Cl) – концентрации основания и соли в полученном буферном растворе, моль/л.
Содержание отчета по лабораторной работе
1. Название работы
2. Цель работы
3. Ход эксперимента
4. Экспериментальные данные согласно протоколу лабораторной работы
5. Обработка экспериментальных данных
6. Выводы
Лабораторная работа № 8. Исследование растворимости солей
Цель работы – определить, каким закономерностям подчиняется растворимость малорастворимых соединений.
Общие сведения
Насыщенным называют раствор, находящийся в равновесии с избытком растворяемого вещества. Концентрацию насыщенного раствора называют растворимостью и обозначают S. Растворимость зависит от температуры и состава раствора.
Рассмотрим равновесие между солью и ее насыщенным раствором. При этом учтем, что все соли – сильные электролиты, полностью диссоциирующие в растворе.
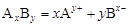 .
.
Константу данного равновесия называют произведением растворимости соли и обозначают L. Запишем ее выражение согласно закону действующих масс:
 .
.
Таким образом, в насыщенном растворе малорастворимого соединения произведение концентраций его ионов в степенях, равных стехиометрическим коэффициентам, при данной температуре – величина постоянная.
|
|
|
Произведение растворимости характеризует сравнительную растворимость веществ: чем больше величина L данного вещества, тем больше его растворимость.
Математическое выражение произведения растворимости используют для расчета концентрации ионов в насыщенных растворах. Значения произведений растворимости обычно приводятся в справочной литературе.
Если произведение концентраций ионов, образующих труднорастворимую соль, выше равновесного значения, то есть правая часть в формуле произведения растворимости больше левой, то в системе будет происходить образование осадка. При противоположном знаке неравенства осадок будет растворяться.
Значение рН, при котором из данного раствора начинает выпадать осадок гидроксида, называют рН гидратообразования. Для расчета этой характеристики используют следующие формулы:
М(ОН)z(т) = М z +(р-р) + z OH-(р-р);
L = [M z +][OH-] z.
Из последней формулы находят концентрацию ионов гидроксила, а затем рН гидратообразования.
Контрольные вопросы
1. Какой раствор называют насыщенным?
2. Какая величина соответствует концентрации насыщенного раствора?
3. От каких факторов зависит концентрация насыщенного раствора хорошо растворимых и трудно растворимых веществ?
4. Что такое произведение растворимости?
5. Как величина произведения растворимости связана с растворимостью вещества?
6. При каком условии будет происходить образование осадка?
7. Что называется рН гидратообразования?
8. По какому уравнению рассчитывают теоретическое значение рН гидратообразования?
9. Что такое дробное осаждение?
10. Что такое переосаждение?
Оборудование и реактивы
В штативе: хлорид калия, хромат калия, хлорид бария, нитрат свинца, хлорид натрия, иодид калия, бромид калия, сульфат натрия, хлорид железа (III), сульфат меди (II), сульфат магния, хлорид кальция, оксалат аммония, гидроксид аммония, – растворы концентрацией 5 %. В вытяжном шкафу: сульфид натрия – раствор концентрацией 5 %; соляная кислота – раствор концентрацией 15 %; уксусная кислота – 2 н. раствор. Получать в лаборантской: пробирки – 5 шт.; сульфат железа (II), нитрат серебра, сероводородная вода, гидроксид натрия, 0,2 н. раствор.
|
|
|
Выполнение работы
Опыт 1. Условия выпадения осадка. В две пробирки внести по 2−3 капли раствора сульфата железа (II). В одну из них добавить такой же объем сероводородной воды, а в другую − раствор сульфида натрия. Отметить, в каком случае выпадает осадок?
Написать ионное уравнение реакции. При каких условиях выпадает осадок? Пользуясь правилом произведения растворимости, объяснить выпадение осадка сульфида железа в одном случае и его отсутствие в другом.
Опыт 2. Дробное осаждение. В двух пробирках получить раздельно хлорид и хромат серебра взаимодействием растворов хлорида и хромата калия с нитратом серебра (по 2−4 капли). Написать ионные уравнения реакций, отметить цвета осадков и записать величину произведения растворимости для хлорида и хромата серебра.
Какая соль менее растворима? Какое вещество будет выпадать в осадок в первую очередь из раствора, содержащего ионы Сl−,  и Ag+ в равных концентрациях?
и Ag+ в равных концентрациях?
В чистую пробирку поместить по 2−3 капли растворов хлорида и хромата калия, добавить 5−6 капель воды и перемешать раствор стеклянной палочкой. Осторожно, по каплям (1−2 капли) прибавлять в него раствор нитрата серебра. Что наблюдается? С какими ионами в первую очередь реагируют ионы серебра? Какое вещество при этом образуется?
Добавить в раствор еще несколько капель нитрата серебра. Наблюдается ли образование хлорида серебра? Отметить начало его образования при дальнейшем увеличении концентрации иона серебра. Объяснить последовательность образования осадков в данном опыте, учитывая величины произведений растворимости хлорида и хромата серебра.
|
|
|


