 |
Описание кинетики процесса
|
|
|
|
Уравнение химической кинетики восстановления двуокиси углерода, найденное на основании представлений о механизме реакции при отсутствии диффузионных торможений и с учетом неоднородности поверхности, имеет вид:

(2.1)
где т – число молей СО2, поступающих в реактор за время t;
 – удельная поверхность угля, м2/кг;
– удельная поверхность угля, м2/кг;
g – масса угля, кг;
t – время, ч;
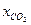 – степень превращения С02;
– степень превращения С02;
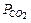 ,
, 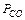 –парциальные давления СО2 и СО, атм.
–парциальные давления СО2 и СО, атм.
Константы прямой и обратной скоростей реакции зависят от температуры процесса и определяются по уравнениям:
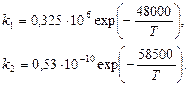
(2.2)
Уравнение кинетики дает возможность рассчитать скорость реакции восстановления двуокиси углерода при заданной температуре опыта в интервале парциальных давлений СО2:
|
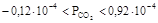
Для численного решения уравнения (2.1) преобразуем его таким образом, чтобы в него была введена независимая переменная – время пребывания.
Подставим в уравнение (2.1) выражение для dg:
dg=  dV, (2.3)
dV, (2.3)
где  – насыпная масса угля, кг/м3;
– насыпная масса угля, кг/м3;
dV –изменение объема массы g угля в процессе реакции, м3.
Объем реакционной массы связан с временем пребывания в реакционной зоне следующим соотношением:
dV=vo d  , (2.4)
, (2.4)
где v0 – объемный расход газа через слой угля, м3/ч.
Таким образом, изменение массы угля как функции времени выразится зависимостью:
dg =  v o d
v o d  . (2.5)
. (2.5)
После подстановки выражения (2.5) в уравнение (2.1) получим:
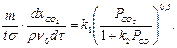 (2.6)
(2.6)
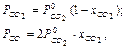 Учитывая, что величины m, t,
Учитывая, что величины m, t,  ,
,  ,v0 постоянны для выбранных условий опыта, обозначим
,v0 постоянны для выбранных условий опыта, обозначим 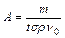 . Если в уравнении (2.6) выразить концентрации компонентов газовой смеси через степень превращения
. Если в уравнении (2.6) выразить концентрации компонентов газовой смеси через степень превращения
(2.7)
то получим:
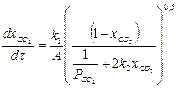 . (2.8)
. (2.8)
Решая уравнение (2.8) численным методом, можно найти зависимость 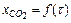 или
или 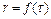 . Исследование процесса восстановления СО2 с помощью уравнения (2.8) необходимо провести для случая с неподвижным слоем твердого реагента, в качестве которого применяется активированный уголь марки БАУ с характеристиками: насыпная плотность р =260 кг/м3, удельная поверхность
. Исследование процесса восстановления СО2 с помощью уравнения (2.8) необходимо провести для случая с неподвижным слоем твердого реагента, в качестве которого применяется активированный уголь марки БАУ с характеристиками: насыпная плотность р =260 кг/м3, удельная поверхность  =57 .103 м2/кг. Процесс проводится при температуре Т = 1000 К. Принять
=57 .103 м2/кг. Процесс проводится при температуре Т = 1000 К. Принять 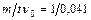 .
.
|
|
|
При определении времени пребывания  для достижения заданной степени превращения задача сводится к вычислению интеграла вида:
для достижения заданной степени превращения задача сводится к вычислению интеграла вида:
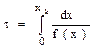 , (2.9)
, (2.9)
где f(x) – правая часть уравнения (2.8).
Задание
Построить зависимость 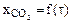 исходя из уравнения кинетики процесса (2.8). Для этого при заданных условиях процесса и характеристиках твердой фазы по программе № 3, приведенной в Приложении А, рассчитать время пребывания для степени превращения в интервале 0<
исходя из уравнения кинетики процесса (2.8). Для этого при заданных условиях процесса и характеристиках твердой фазы по программе № 3, приведенной в Приложении А, рассчитать время пребывания для степени превращения в интервале 0<  <0,9. Значение парциального давления
<0,9. Значение парциального давления 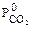 взять из таблицы 2.1 согласно номеру варианта. Экспериментальные значения времени пребывания для различных степеней превращения взять из таблицы 2.3. Результаты численного эксперимента и опытные данные свести в таблицу 2.2. По этим данным построить график в координатах "
взять из таблицы 2.1 согласно номеру варианта. Экспериментальные значения времени пребывания для различных степеней превращения взять из таблицы 2.3. Результаты численного эксперимента и опытные данные свести в таблицу 2.2. По этим данным построить график в координатах " 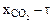 ", как показано на рисунке 2.1. Сравнивая полученные зависимости, определить область протекания процесса.
", как показано на рисунке 2.1. Сравнивая полученные зависимости, определить область протекания процесса.
Таблица 2.1 – Варианты заданий
| Номер варианта | |||||||||
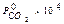
| 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 |
Таблица 2.2 – Результаты расчетов
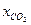
| |||||||||
 расчетное, ч расчетное, ч
| |||||||||
 экспериментальное, ч экспериментальное, ч
|
Таблица 2.3 – Экспериментальные значения времени пребывания для различных степеней превращения, ч
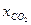
| 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 |
| 0,26 | 0,54 | 0,84 | 1,15 | 1,5 | 1,88 | 2,32 | 2,84 | 3,51 | |
| 0,18 | 0,38 | 0,59 | 0,82 | 1,06 | 1,33 | 1,64 | 2,00 | 2,48 | |
| 0,15 | 0,31 | 0,48 | 0,67 | 0,87 | 1,09 | 1,34 | 1,64 | 2,02 | |
| 0,13 | 0,27 | 0,42 | 0,58 | 0,75 | 0,94 | 1,16 | 1,42 | 1,75 | |
| 0,12 | 0,24 | 0,37 | 0,52 | 0,67 | 0,84 | 1,04 | 1,27 | 1,57 | |
| 0,11 | 0,22 | 0,34 | 0,47 | 0,61 | 0,77 | 0,95 | 1,16 | 1,43 | |
| 0,10 | 0,20 | 0,31 | 0,43 | 0,57 | 0,71 | 0,88 | 1,07 | 1,32 | |
| 0,09 | 0,19 | 0,29 | 0,41 | 0,53 | 0,66 | 0,82 | 1,00 | 1,24 | |
| 0,08 | 0,18 | 0,28 | 0,38 | 0,50 | 0,63 | 0,77 | 0,94 | 1,17 |
|
|
|

1 – теоретическая кривая; 2 – экспериментальная кривая
Рисунок 2.1 – Изменения степени превращения 
от времени пребывания
2.5 Контрольные вопросы
1. Зачем проводится газификация топлива?
2. Какие реакции называются гетерогенными?
3. Какие области протекания гетерогенного процесса вы знаете?
4. Что такое лимитирующая стадия?
5. Как определяется лимитирующая стадия гетерогенного процесса?
6. Роль температуры и давления в проведении процесса восстановления двуокиси углерода.
7. Какие способы повышения степени превращения реагента применяются в промышленных условиях?
ЛАБОРАТОРНАЯ РАБОТА № 3.
|
|
|


