 |
Краткие теоретические сведения
|
|
|
|
Химические реакции, как правило, сопровождаются выделением или поглощением тепла, что приводит к изменению температуры реакционной массы. От температуры зависят состояние химического равновесия и предельно достижимая степень превращения реагентов, скорость реакции, селективность и ряд других факторов. Для регулирования процесса в нужном направлении необходимо обеспечить тот или иной температурный режим.
Химические реакторы по способу организации температурного режима делятся на следующие типы:
• изотермические (температура реакции постоянна);
• адиабатические (отсутствие теплообмена с окружающей средой);
• политропические (частичный подвод или отвод тепла).
Для контроля над ходом реакции нужно регулировать температуру в пределах заданного диапазона. Этого можно достичь осуществлением соответствующего теплообмена. В промышленных аппаратах не всегда целесообразно поддерживать действительно изотермические условия. Процесс можно вести в промежуточном режиме (политропический процесс), организуя теплообмен с внешним источником тепла через поверхность теплообмена. Одним из способов управления температурой является изменение скорости теплопередачи путем регулирования расхода теплоносителя или изменения температуры конденсации его паров.
Учет тепловых явлений осуществляется при составлении теплового баланса химического реактора. При расчете неизотермического реактора необходимо совместно решать систему уравнений материального и теплового балансов, из которых первое учитывает изменение количества вещества, а второе – изменение количества теплоты при протекании химического процесса.
|
|
|
Рассмотрим необратимую реакцию первого порядка А  S, проводимую в реакторе идеального вытеснения с тепловым эффектом
S, проводимую в реакторе идеального вытеснения с тепловым эффектом 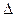 Н. В реакционной смеси содержится инертное вещество с концентрацией CR. Чтобы избежать образования побочных продуктов, для регулирования температуры в рубашку кожухотрубного реактора подают противотоком воду. Составим уравнения математического описания этого процесса.
Н. В реакционной смеси содержится инертное вещество с концентрацией CR. Чтобы избежать образования побочных продуктов, для регулирования температуры в рубашку кожухотрубного реактора подают противотоком воду. Составим уравнения математического описания этого процесса.
Уравнения материального баланса для РИВ в стационарных условиях имеют вид:
 (5.1)
(5.1)
Уравнения теплового баланса для реакционного потока и теплоносителя:
 (5.2)
(5.2)
Зависимость константы скорости реакции от температуры описывается уравнением
 (5.3)
(5.3)
Теплоемкость смеси можно определить по правилу аддитивности:
СР = СРАСА +CPSCS +CPRCR. (5.4)
В уравнения (5.1)–(5.4) входят величины:
СА, Cs –концентрации исходного вещества и продукта соответственно, моль/м3;
CR – концентрация инертного компонента, моль/м3;
СРА , СРS , CPR – теплоемкости компонентов, Дж/(кг·К);
СР – теплоемкость реакционной смеси, Дж/(кг·К);
Т, ТT –температуры соответственно реакционного потока и теплоносителя, К;
k –константа скорости реакции, м3/(моль·с);
k0 –предэкспоненциальный множитель;
Е –энергия активации, Дж/моль;
R – газовая постоянная, Дж/(кмоль ·К);
FT –поверхность теплообмена, м2;
КT –коэффициент теплопередачи, Вт/(м2·К);
VR –объем реактора, м3;
 –среднее время пребывания в реакторе, с;
–среднее время пребывания в реакторе, с;
v T –массовый расход теплоносителя, кг/с;
СRT – теплоемкость теплоносителя, Дж/кг·К.
Система уравнений (5.1)–(5.4) полностью описывает процесс химического превращения в реакторе идеального вытеснения и может быть решена любым численным методом относительно требуемых величин.
Задание
Реализуя численный эксперимент с помощью математической модели, определить концентрационный и температурный профиль по длине аппарата. Определить расход теплоносителя, обеспечивающий заданные начальные и конечные температуры теплоносителя. Определить степень превращения реагента А. Исследовать влияние начальной температуры реакционного потока и расхода теплоносителя на степень превращения исходного реагента. Сделать необходимые выводы.
|
|
|
Исходные данные:
CR = 10,8 кмоль/м3;  Cpa = Cps = 62 кДж/(кмольК);
Cpa = Cps = 62 кДж/(кмольК);
CPR = 53 кДж/(кмоль К); 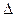 Н = - 448.104 кДж/(кмоль);
Н = - 448.104 кДж/(кмоль);
k0 =1,84 . 105; Е = - 44900 Дж/моль;  Ттк = 293 К;
Ттк = 293 К;
Кт = 0,320 кВт/(м2·К); Ft = 14,16 м2; СРТ = 4,190 кДж/(кг·К);
VR = 0,283 м3;  =- 3600 с; L = 5,9 м;
=- 3600 с; L = 5,9 м;  =103 кг/кмоль.
=103 кг/кмоль.
Начальную концентрацию реагента А выбрать из таблицы 5.1 согласно номеру варианта.
Таблица 5.1 – Варианты заданий
| Номерварианта | |||||||||

| 1,5 | 1,6 | 1,7 | 1,8 | 2,0 | 2,2 | 2,4 | 2,6 | 2,8 |
Поиск расхода теплоносителя в интервале 0,1< vT <3,0 осуществляется с помощью итерационной процедуры в моделирующем алгоритме.
Исследования по влиянию начальной температуры реакционного потока на степень превращения выполнить при 296 К< Т <306 К. По полученным данным построить графики в координатах СА, Т = f( ) при одном значении Т0 и XA=f (vT,T0).
) при одном значении Т0 и XA=f (vT,T0).
5.4 Контрольные вопросы
1. Принцип составления уравнения теплового баланса адиабатического реактора.
2. В каких случаях применяются адиабатические реакторы для проведения химических процессов, в каких политропические?
3. Каким образом конструктивно оформляется политропический процесс?
4. Какой температурный режим называется оптимальным?
5. Способы осуществления оптимального температурного режима в промышленных реакторах.
ЛАБОРАТОРНАЯ РАБОТА № 6.
|
|
|


