воздухе постепенно выветриваются, окисляясь с поверхности и переходя в желто-бурую основную соль железа (III) FeOHSO4.
Двойные сульфаты - это кристаллогидраты с общей формулой M2SO4´M2(SO4)3´24H2O, где M+ – K+, Na+, NH4+, Rb+ или Cs+; M3+ – Cr3+, Al3+, Fe3+ и др. трехзарядные ионы.
Примеры: K2SO4´Al2(SO4)3´24H2O или KAl(SO4)2´12H2O. Часто пользуются тривиальными названиями этих соединений - алюмокалиевые квасцы, или просто квасцы.
K2SO4´Cr2(SO4)3´24H2O или KCr(SO4)2´12H2O - хромовокалиевые квасцы (иногда слово "калиевые" опускают и указывают просто хромовые квасцы), KFe(SO4)2´12H2O - железокалиевые (железные) квасцы, NH4Fe(SO4)2´12H2O - железоаммонийные квасцы (12 гидрат сульфата калия, хрома (III)).
Соль Мора – (NH4)2SO4´FeSO4´6H2O или (NH4)2Fe(SO4)2´6H2O. Это обычная двойная соль с кристаллизационной водой, не относится к квасцам, т.к. железо имеет степень окисления +2 (а не +3, как в квасцах).
В этой соли железо (II) более устойчиво к окислению кислородом в отличие от железного купороса. Двойные соли серной кислоты существуют только в твердом виде, в водных растворах распадаются на ионы:
KAl(SO4)2 ® K+ + Al3+ + 2SO42-
Сульфат и гидросульфат ионы обладают слабым поляризующим действием, величина делокализованного заряда на атомах кислорода в SO42- - ионе равна -0,5, поэтому эти ионы гидролизу практически не подвергаются. Гидролиз сульфатов возможен лишь по катиону, если он обладает поляризующим действием.
Из гидросульфатов в твердом состоянии получены гидросульфаты активных металлов: NaHSO4, KHSO4 и др.
Сульфаты являются достаточно термически устойчивыми веществами: сульфаты натрия, калия и бария плавятся без разложения при температуре ~1000 °С и выше, другие распадаются при температурах >700-800 °С с образованием оксида металла и SO2 (или SO2 + O2), например:
2Fe2(SO4)3 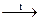 2Fe2O3 + 6SO2 + 3O2 2Fe2O3 + 6SO2 + 3O2
2FeSO4 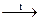 Fe2O3 + SO3 + SO2 Fe2O3 + SO3 + SO2
HgSO4 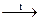 Hg + SO2 + O2 Hg + SO2 + O2
Кристаллогидраты при нагревании сначала теряют воду, а затем при сильном прокаливании разлагаются:
CaSO4´2H2O  CaSO4 + 2H2O CaSO4 + 2H2O
| 



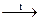 2Fe2O3 + 6SO2 + 3O2
2Fe2O3 + 6SO2 + 3O2 CaSO4 + 2H2O
CaSO4 + 2H2O