Вопросы и задачи для самоподготовки:
1. Напишите электронные формулы атомов Cu, Ag, Au.
2. В чем их особенность? Какие степени окисления для них возможны, а какие характерны?
3. Напишите электронные формулы возможных ионов Cu,Ag,Au. Укажите тип их электронной конфигурации.
4. Охарактеризуйте гидроксид меди (II).
5. Чем объяснить, что во многих комплексных соединения меди (II) координационное число меди равно четырем, а не шести; приведите примеры КС меди (II) и уравнения реакции их получения.
6. Окислительные свойства соединений меди (II).
7. Соединения меди (I): гидроксид, соли. Получение, растворимость.
8. Обнаружение соединений меди.
9. Охарактеризуйте биологическую роль меди.
10. В чем проявляется токсичность соединений меди?
11. Какие соединения меди применяются в медицине и фармации?
12. Соединения серебра (I). Почему ион Ag+ практически не подвергается гидролизу? Какие соли серебра (I) легко растворимы в воде?
13. Приведите формулы галогенидов серебра (I); какие из них и почему легко растворяются в воде и в концентрированном растворе аммиака? Напишите соответствующие уравнения реакций.
14. Напишите уравнения реакций, характеризующих окислительные свойства серебра (I).
15. Биологическая роль и токсичность соединений серебра.
16. Применение соединений серебра в медицине и фармации.
D - Элементы II группы
К d-элементам II группы ПС относятся цинк - Zn, кадмий -Cd, ртуть -Hg. Для них характерна электронная конфигурация...(n-1)s2(n-1)p6(n-1)d10ns2; предвнешняя псевдоблагородногазовая оболочка при ns2 очень стабильна, поэтому Zn, Cd, Hg не образуют ионов с незавершенным d-подуровнем и к переходным металлам не относятся. Они проявляют степень окисления +2 (для ртути возможна степень окисления +1). Ионы, имеющие псевдоблагородногазовую конфигурацию, характеризуются большой энергией гидратации (-437 ккал/моль у Cd и -492 ккал/моль у Zn) и поляризующим действием, поэтому в водных растворах подврегаются гидролизу; ионы в растворах бесцветны, поэтому соединения этих элементов не окрашены (исключение оксид, сульфид, иодид ртути (II)).
Стандартные окислительно-восстановительные потенциалы у Zn и Cd отрицательные; Hg характеризуется положительным стандартным окислительно-восстановительным потенциалом, поэтому относится к полублагородным металлам. В комплексных соединениях орбитали | 



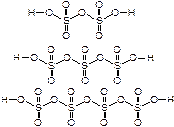
 5ZnO+2CO2 + 3H2O
5ZnO+2CO2 + 3H2O (SO3)3
(SO3)3  (SO3)¥
(SO3)¥