 |
Лекарственные препараты ртути
|
|
|
|
Несмотря на высокую токсичность, некоторые препараты ртути находили применение как антисептические средства при гнойничковых заболеваниях кожи и мочеполовой системы.
Hydrargyri oxydum flavum (HgO) – ртути оксид желтый, как антисептическое средство в виде мазей в глазной практике и при заболеваниях кожи.
Hydrargyri amidochloridum (HgNH2Cl) – ртути амидохлорид, в виде мазей при пиодермиях кожи.
Hydrargyri chloridum (HgCl2) – ртути дихлорид (сулема) в виде раствора (1:1000) для дезинфекции одежды, предметов ухода за больными.
Работать с соединениями ртути в виду их высокой токсичности надо очень осторожно.
Применение соединений ртути в фармации
Реактив Несслера (щелочной раствор тетраиодомеркурата (II) калия K2[HgI4] + KOH) используют для обнаружения аммиака и ионов аммония.
Вопросы и задачи для самоподготовки
1. Охарактеризуйте положение Zn, Cd и Hg в ПС. Напишите электронные формулы их атомов. Какие ионы они образуют?
2. Почему Zn, Cd и Hg не относят к переходным металлам?
3. Соединения цинка: оксид, гидроксид, их амфотерность.
4. Комплексные соединения цинка: гидроксокомплекс, аммиакат, получение, окраска.
5. Обнаружение соединений цинка.
6. Биологическая роль цинка.
7. Токсичность соединений цинка.
8. Применение соединений цинка в медицине.
9. Биологическая роль и токсическое действие соединений кадмия.
10. Соединения ртути (II): оксид, получение, свойства.
Хлорид ртути (II): получение, растворимость, гидролиз, фотолиз,


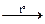 2Fe2О3 + 8SO2 (S22- - восстановитель)
2Fe2О3 + 8SO2 (S22- - восстановитель) S¯ + 2Н+
S¯ + 2Н+ SO2 + …
SO2 + …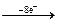 H2SO4
H2SO4