 |
Работа № 29. Зависимость скорости реакции
|
|
|
|
ОТ КОНЦЕНТРАЦИИ РЕАГИРУЮЩИХ ВЕЩЕСТВ
Цель работы − исследование влияния изменения концентрации веществ на скорость химических реакций.
Зависимость скорости реакции от концентрации можно изучить, пользуясь реакцией взаимодействия серноватисто-кислого (тиосульфата) натрия с серной кислотой:
Nа2 S2O3 + Н2 SO4 → Nа2 SO4 + H2O + SO2 + S↓.
Выделившаяся из раствора сера делает раствор мутным. По промежутку времени от начала реакции до заметного помутнения раствора можно судить об относительной скорости этой реакции.
Оборудование
1. Бюретки.
2. Химические стаканы.
3. Метроном.
Порядок выполнения работы
1. Заполнить выше нулевого деления три бюретки, закрепленные в штативе: первую – 2 нраствором тиосульфата, вторую − дистиллированной водой, третью − раствором серной кислоты (см. правила пользования бюреткой).
2. В семи стаканах приготовить растворы Nа2S2O3в воде в соотношениях, указанных в таблице:
| Номер стакана | Раствор Na2S2O3,мл | Н2O, мл |
| 4 5 б 7 | 1,5 3,0 4,5 6,0 7,5 12,0 16,5 | 15,0 13,5 12,0 10,5 9,0 4,5 |
3. Налить в стакан № 1 из бюретки 1,5 мл 1 н раствора серной кислоты, перемешать раствор и сразу же включить метроном (момент сливания должен совпадать с моментом удара метронома, который принять за ноль отсчета). При появлении едва заметной мути опыт прекратить. Результаты (число ударов метронома) записать.
4. Повторить опыт со смесями в стаканах № 2−7.
5. По окончании каждого опыта тщательно вымыть стаканы.
6. Результаты свести в таблицу.
7. На миллиметровой бумаге начертить график зависимости v (ось ординат) от C (ось абсцисс).
8. Сделать вывод о зависимости скорости реакции vот концентрацииреагирующих веществ. Как согласуются ваши наблюдения с законом действующих масс?
|
|
|
| Номер стакана | Объем, мл Nа2S2O3 H2O Н2SO4 (а) (б) (в) | Общий объем смеси, мл | Концентрация
Nа2S203

| Промежуток времени от начала счета до помутнения τ | Скорость реакции

|
Работа № 30. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ И КАТАЛИЗАТОРА
Опыт № 1. Влияние температуры на скорость реакции
Цель работы − исследование влияния температуры на скорость химической реакции.
Зависимость скорости реакции от температуры можно наблюдать, пользуясь реакцией взаимодействия тиосульфата натрия с серной кислотой:
Na2S2O3 + Н2SО4 → Nа2SO4 + Н2O + SO2 + S↓,
в которой образующаяся твердая сера будет вызывать помутнение раствора.
Оборудование
1. Три стакана емкостью 300−400 мл.
2. Термометры.
3. Метроном (или секундомер).
Порядок выполнения работы
1. Налить воды в три стакана емкостью каждого 300−400 мл на 3/4 объема. Стаканы накрыть картонными крышками с тремя отверстиями, в одно из которых вставить термометр (два других отверстия предназначены для пробирок).
2. Поставить стаканы на асбестовую сетку. Один из них оставить при комнатной температуре, два других нагреть до определенных температур, различающихся между собой на 10°С, таким образом, чтобы температура воды в стакане № 1 была комнатной, в стакане № 2 − на 10°С выше комнатной, в стакане № 3 − на 10°С выше, чем в стакане № 2. Температуру поддерживать постоянной в течение всего опыта. Они будут выполнять роль термостатов.
3. В одно из свободных отверстий в крышке каждого стакана вставить пробирку с 2 н раствором кислоты и опущенной в нее пипеткой. В другое отверстие поместить пробирку с 10 мл 0,5 н раствора тиосульфата натрия.
4. Не вынимая пробирку с тиосульфатом натрия из стакана № 1, добавить в нее одну каплю 2 н серной кислоты из пробирки, находящейся в том жестакане. По метроному (или по секундомеру) отсчитать время до появления заметной мути.
|
|
|
5. Повторить опыт с растворами тиосульфата и серной кислоты в стаканах
№ 2 и 3, измеряя время течения реакции, как и в первом случае.
6. Данные наблюдений записать в таблицу:
| Номер наблюдения | Температура опыта | Время течения реакции, мин. или число ударов метронома | Скорость реакции в условных единицах
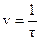
|
7. Сделать вывод о зависимости скорости химической реакции от температуры.
8. По полученным данным построить график зависимости скорости реакции от температуры, откладывая по оси абсцисс температуру, а по оси ординат − относительную скорость реакции.
9. Рассчитать температурный коэффициент скорости реакции γ.
|
|
|


