 |
Опыт № 2. Влияние катализатора на скорость химической реакции
|
|
|
|
Цель работы − исследование влияния катализаторов на скорость химической реакции на примере каталитического разложения пероксида водорода.
Оценку активности различных катализаторов можно дать на основании наблюдений за объемом выделения кислорода за определенный промежуток времени по реакции:
2H2O2 →2H2O + O2
Скорость разложения пероксида можно изменять, вводя различные катализаторы.
Опыт позволяет наглядно оценить активность различных катализаторов путем сравнения объемов кислорода, выделившегося в реакции за один и тот же определенный промежуток времени.
Оборудование
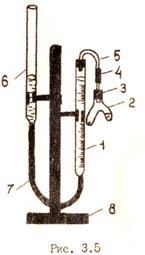
Схема прибора, используемого в работе, приведена на рис. 3.5. Основными частями прибора являются: рабочая бюретка (1); двухколенная пробирка − пробирка Оствальда (2), соединенная с рабочей бюреткой резиновой пробкой (3), каучуковой (4) и стеклянной (5) трубками; вспомогательная бюретка (6), используемая в качестве уравнительного сосуда.
В бюретке находится вода, которую выделяющийся в результате реакции газ вытесняет из рабочей бюретки во вспомогательную. Прибор укрепляется в штативе (8).
Порядок выполнения работы
1. Снять с пробки двухколенную пробирку.
2. Рабочую бюретку укрепить в штативе так, чтобы уровень воды в бюретке совпадал с нулевым делением. Отсчеты уровня жидкости производить по нижнему краю мениска, который должен быть на уровне глаз наблюдателя.
3. В одну часть двухколенной пробирки поместить катализатор (наливать или насыпать его необходимо очень аккуратно, следя за тем, чтобы он не попал в другую часть пробирки).
4. В другую часть пробирки также осторожно налить 2 мл 2,5%-ного раствора пероксида водорода.
|
|
|
5. Двухколенную пробирку плотно надеть на пробку (уровень жидкости в рабочей бюретке при этом незначительно сместится с нулевого деления).
6. Привести давление в пробирке к атмосферному, установив уровни воды в бюретках на одной высоте.
7. Отметить уровень воды в рабочей бюретке до начала разложения перекиси водорода.
|
8. Проверить прибор на герметичность, так как для успешного выполнения работы необходимо без потерь собрать весь выделившийся кислород. Для этого вспомогательную бюретку либо поднять, либо опустить на 15 − 20 см. Если прибор герметичен, уровень воды в рабочей бюретке сначала снизится, а затем останется без изменения. При возвращении вспомогательной бюретки на прежнее место вода в рабочей бюретке должна быть на том же исходном уровне.
9. Если обнаружится, что прибор не герметичен, необходимо найти причину неполадки и устранить ее, проверив надежность пробок и каучуковой трубки, соединяющей двухколенную пробирку с рабочей бюреткой.
10. После того как установлено, что прибор герметичен, повернуть пробирку таким образом, чтобы привести в контакт перекись водорода с катализатором, отмечая время их соприкосновения.
11. По истечении 2 мин. записать объем выделившегося кислорода, для чего
установить мениски воды в обоих бюретках на одном уровне (это условие приведения газа в пробирке к атмосферному давлению).
12. Записать объем выделившегося кислорода. По окончании опыта тщательно вымыть сосуд.
13. Результаты опыта занести в таблицу:
| Состав, агрегатное состояние, количество | Время реакции | Объем выделившегося кислорода, мл | Вывод | |
| реагирующего вещества | катализатора | |||
14. Сделать вывод об активности катализаторов в гомогенном и гетерогенном катализе.
Описанным способом измерить каталитическое действие следующих катализаторов на разложение пероксида водорода: 1) твердый МпО2 − 0,1 г, 2) активированный уголь − 0,1 г, 3) 40%-ный раствор СuС12 −0,5 мл,
|
|
|
4) 20% -ный раствор FeCl3 − 0,5 мл.
Опыт повторить с теми же катализаторами, но с пероксидом водорода, стабилизированным 2%-ной фосфорной кислотой.
Заметить, какое влияние оказывает ортофосфорная кислота на разложение пероксида водорода.
Вопросы и задачи к разделу II
1. Что такое скорость химической реакции?
2. От каких факторов зависит скорость химической реакции?
3. Каков физический смысл константы скорости?
4. Что называется порядком реакции и молекулярностью? В каких случаях порядок и молекулярность не совпадают?
5. Зависимость скорости реакции от концентрации; закон действия масс для гомогенных и гетерогенных процессов.
6. Влияние температуры на скорость реакции. Правило Вант-Гоффа.
7. Что называется энергией активации? Напишите уравнение Аррениуса.
8. Какие вещества называются катализаторами? Механизм действия катализаторов.
9. Какие реакции называются цепными? Каков их механизм?
10. При 150 оС некоторая реакция заканчивается за 16 мин. Принимая температурный коэффициент реакции равным 2,5, рассчитайте, через сколько минут закончилась бы эта реакция при 200 оС ; при 80 оС .
11. Во сколько раз следует увеличить концентрацию водорода, чтобы скорость реакции N2 + 3H2 = 2NH3 возросла в 1000 раз? Как нужно изменить давление, чтобы добиться такого же ускорения реакции?
Раздел III.
ФИЗИКО−ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЕЩЕСТВ
ГЛАВА 4. ФИЗИКО−ХИМИЧЕСКИЙ АНАЛИЗ
Работа № 31. ИЗУЧЕНИЕ ДИАГРАММЫ ПЛАВКОСТИ СИСТЕМЫ ФЕНОЛ−НАФТАЛИН
Цель работы − ознакомление с методом термического анализа и построение диаграммы плавкости двухкомпонентной системы.
Диаграмма плавкости двухкомпонентной системы представляет собой кривую, построенную в координатах «температура плавления (кристаллизации) – состав смеси». Для построения диаграммы, таким образом, нужно измерить температуру плавления (кристаллизации) чистых веществ − нафталина и фенола и сплавов различного состава.
Оборудование и реактивы
1. 10 пробирок с пробками, имеющими отверстия для термометров.
2. Термометры.
|
|
|
3. Смеси фенола и нафталина в различном соотношении (см. таблицу).
Порядок выполнения работы
1. Получить у лаборанта пробирки со смесями фенола и нафталина известного состава.
2. Вставить в пробирки термометры таким образом, чтобы ртутные шарики термометров вставленных в пробки пробирок были погружены в сплав.
3. Одну из пробирок со смесью поместить в стакан с холодной водой и нагреть на пламени горелки. Когда начнется плавление, уменьшить пламя горелки.
4. Наблюдать за показаниями термометра и записать температуру, при которой расплавятся последние кристаллы (температура плавления).
5. Вынуть пробирку из стакана и, охлаждая ее на воздухе, наблюдать за появлением первых кристаллов.
6. Записать температуру, при которой они появились (температура кристаллизации).
7. Повторить аналогичные опыты с остальными пробирками, состав которых указан в таблице.
8. Результаты опытов записать в таблицу:
| Номер пробирки | Состав смеси, % | Температура плавления | Температура кристаллизации | |
| Нафталин | Фенол | |||
9. По данным опыта построить диаграмму плавкости системы, определить процентный состав эвтектической смеси и ее температуру плавления.
Контрольные вопросы
1. В чем сущность физико-химического анализа?
2. Какую зависимость выражает диаграмма плавкости?
3. Что называется эвтектикой?
4. Что называется числом степеней свободы?
5. Сформулируйте правило фаз.
Глава 5. ФИЗИКО−ХИМИЧЕСКИЕ СВОЙСТВА ПОЛИМЕРОВ
|
|
|


