 |
Общие сведения о рефрактометрии
|
|
|
|
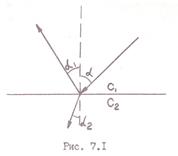
Рефрактометрический метод анализа основан на измерении показателя преломления световых лучей при прохождении их через границу раздела сред. При этом световой пучок частично отражается, а частично переходит в другую среду, изменяя свое направление, т.е. преломляясь (рис. 7.1). Углы, образуемые падающим, отраженным и преломленным пучками света с перпендикуляром к границе раздела сред, называются соответственно углами падения α, отражения α1 и преломления α2. Показатель преломления равен отношению синусов угла падения и угла преломления:
 (7.1)
(7.1)


Когда говорят о показателях преломления твердых и жидких тел, то обычно имеют в виду их относительные показатели преломления по отношению к воздуху. Эти величины обозначают буквой n и называют просто показателями преломления.
Величина показателя преломления индивидуальных веществ зависит от природы атомов, входящих в их состав, и строения их молекул. Эта зависимость обусловлена различной поляризуемостью частиц. Способность атомов и молекул приобретать в электромагнитном поле дипольный момент называется поляризуемостью α. Чем выше поляризуемость, тем сильнее преломление света (тем больше угол преломления).
Изменение плотности d вещества заметно отражается на величине показателя преломления n. В самом общем виде зависимость показателя преломления от плотности вещества
f(n) = kудd, (7.2)
где kуд – коэффициент преломляемости, называемый удельной рефракцией.
Таким образом, не сам показатель преломления, но некоторая функция от него находится в прямой пропорциональной зависимости от плотности вещества d..
Поляризуемость молекулы есть суммарный эффект поляризуемости входящих в ее состав атомов. Следовательно, численное значение молекулярной рефракции должно быть суммой атомных рефракций. Поэтому говорят, что молекулярная рефракция обладает свойством аддитивности.
|
|
|
Определив экспериментально показатель преломления и зная молекулярную массу и плотность исследуемого вещества, легко рассчитать молекулярную рефракцию данного соединения:
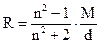 . (7.3)
. (7.3)
Величина рефракции зависит как от качественного, так и от количественного состава молекул. Например, молекулярная рефракция каждого следующего члена гомологического ряда углеводородов отличается на некоторую, почти постоянную величину (инкремент), характерную для группы СН2. Из этого инкремента может быть выведена величина атомной рефракции для углерода и водорода. Вычитая значение рефракции для n групп CH2 из величины молекулярной рефракции углеводорода CnH2n+2, получаем значение рефракции для двух атомов водорода. Подобно этому можно определить атомную рефракцию кислорода путем вычитания инкремента n CH2 из рефракции альдегида CnH2nО.
В свою очередь по атомной рефракции можно вычислить молекулярную рефракцию различных соединений. Однако, рефракция зависит и от характера связей между атомами в молекуле. При наличии в молекулах двойных и тройных связей наблюдается возрастание рефракции на определенную величину, т.е. некоторое отклонение от аддитивности. Это объясняется тем, что на рефракцию главным образом оказывают влияние внешние электроны, поэтому каждый валентный электрон вносит приблизительно одинаковый вклад в общую рефракцию.
Спектры поглощения
Данные относительно интенсивности поглощения излучения можно получить из уравнения Ламберта−Бера.
Вероятность поглощения фотона света молекулой исследуемого вещества обычно прямо пропорциональна концентрации поглощающих молекул и толщине образца. Математически эта величина выражается уравнением
|
|
|
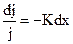 , (7.4)
, (7.4)
где j – интенсивность излучения определенной длины волны (т.е. это число фотонов, приходящихся на единицу площади в единицу времени); dj − изменение интенсивности излучения при поглощении его тонким слоем вещества толщиной dx, имеющим концентрацию С. Величина К определяется толщиной кюветы, в которую помещено вещество, и рассматривается в направлении луча поглощенного света.
При использовании десятичных логарифмов закон Ламберта−Бера записывается в виде
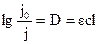 ,(7.5)
,(7.5)
где ε = 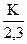 – молярный коэффициент поглощения; с – концентрация вещества;
– молярный коэффициент поглощения; с – концентрация вещества;
l – толщина слоя (кюветы).
Величина 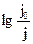 называется оптической плотностью D. Из уравнения (7.5) видно, что оптическая плотность прямо пропорциональна концентрации с и толщине слоя l. Константа пропорциональности зависит от природы растворителя, от длины волны света и температуры.
называется оптической плотностью D. Из уравнения (7.5) видно, что оптическая плотность прямо пропорциональна концентрации с и толщине слоя l. Константа пропорциональности зависит от природы растворителя, от длины волны света и температуры.
Закон Ламберта–Бера соблюдается только для монохроматического излучения (т.е. излучения строго определенной длины волны).
Для смесей веществ, поглощающих свет независимо друг от друга, оптическая плотность выражается уравнением
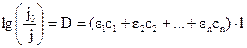 , (7.6)
, (7.6)
где с1, с2, сn – концентрации веществ, имеющих коэффициенты поглощения ε1; ε2 …εn соответственно.
Спектры поглощения могут быть использованы для определения констант диссоциации слабых органических кислот. Спектральный метод основан на различии в спектрах поглощения аниона и молекулы кислоты. Другими словами, если какая-либо органическая кислота диссоциирует по схеме НА ↔ Н+ + А-, то максимумы полос поглощения молекул НА и аниона А- находятся при различных длинах волн.
На основании экспериментально определенных значений оптических плотностей растворов при различных длинах волн возможно определить равновесную концентрацию анионов и кислоты.
При полной диссоциации кислоты (когда степень диссоциации α = 1) равновесие НА ↔ Н+ + А- сдвинуто вправо и в спектре останется одна полоса, соответствующая поглощению только аниона А-. В другом предельном случае, когда при низком значении рН диссоциация кислоты будет практически подавлена
(α = 0), т.е. равновесие реакции будет смещено влево, в спектре останется одна полоса, принадлежащая поглощению кислоты.
|
|
|
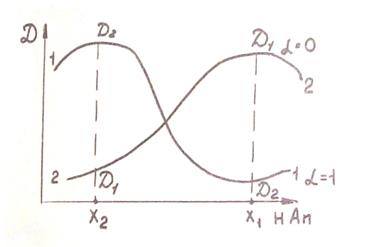
Рис. 7.2
На рис. 7.2 приведены спектры поглощения растворов слабой кислоты (НА) при различных значениях рН. Кривая 1 принадлежит полностью диссоциированному раствору, кривая 2 – раствору, в котором диссоциация практически подавлена:
Рассчитав α по формуле
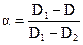 , (7.7)
, (7.7)
где D1 и D2 – предельные величины оптической плотности при низких и высоких значениях рН соответственно, D − оптическая плотность исследуемого раствора при данных значениях рН, можно рассчитать рК и К кислоты:
 . (7.8)
. (7.8)
В качестве органической кислоты, например в работе № 38, используется индикатор хлорфеноловый красный (дихлорфенолсульфогалеин). В кислой среде это вещество имеет желтую окраску, в нейтральной и щелочной – пурпурную.
Контрольные вопросы
1. Что такое рефракция?
2. В чем заключается поляризация атомов и молекул?
3. Какие факторы влияют на величину показателя преломления?
4. Где применяют метод рефрактометрии?
5. Дайте характеристику ковалентной связи.
6. Дайте характеристику ионной связи.
7. Что такое молекулярная рефракция?
8. Что такое электроотрицательность?
9. Рассчитайте концентрацию раствора глюкозы, зная, что показатель преломления раствора n = 1,348. Эмпирический коэффициент К = 0,0014. Показатель преломления растворителя n = 1,330.
|
|
|


