 |
Коллоидные поверхностно-активные вещества
|
|
|
|
К коллоидным поверхностно-активным веществам относятся такие ПАВ, которые в одном и том же растворителе могут находиться одновременно в виде молекул (ионов), образуя истинный гомогенный раствор, и в виде агрегатов молекул - мицелл, давая лиофильную нанодисперсную систему. В системе устанавливается обратимое термодинамическое равновесие истинный раствор ↔ золь.
Самопроизвольному образованию лиофильных дисперсных систем отвечает условие Δ G <0
Δ G = Δ H - T Δ S (2.1)
Поскольку образуется гетерогенная система, поверхностная энергия должна быть скомпенсирована энтропийной составляющей, т.е. частицы дисперсной системы должны участвовать в молекулярно-кинетическом (тепловом) движении. Отсюда следует, что лиофильные системы могут быть только ультрадисперсными, а поверхностное натяжение на границе частица - среда должно быть очень мало.
Значение поверхностного натяжения, при котором обеспечивается термодинамическая устойчивость дисперсных систем, определяется соотношением Ребиндера - Щукина:
σкрит ≤ γ KT / a2 (2.2)
где γ - безразмерный коэффициент; K - константа Больцмана; а - средний размер частиц.
Расчёты показывают, что межфазное поверхностное натяжение в лиофильных дисперсных системах в зависимости от размера частиц может иметь значения в пределах от 0,1 до 0,01 мДж/м2.
Мицеллообразование в растворах коллоидных ПАВ является наиболее термодинамически выгодным процессом по сравнению с процессами образования истинного раствора или разделения фаз. Это обусловлено переходом углеводородной или полярной части дифильных молекул ПАВ в подобную им по полярности фазу. Например, полярные группы молекул ПАВ обращаются к воде, поскольку они гидратированы, а углеводородные радикалы выталкиваются из водной фазы.
|
|
|
Мицеллы характеризуются числом агрегации (числом молекул в мицелле) и мицеллярной массой (суммой молекулярных масс молекул ПАВ, входящих в мицеллу). Мицеллообразование происходит при кооперативном связывании между собой углеводородных хвостов молекул ПАВ при концентрациях, превышающих узкую область, называемую критической концентрацией мицеллообразования (ККМ).

Рис. 4. Изменение свойств водных растворов с ростом концентрации мицеллообразующего ПАВ.
ККМ - это концентрация ПАВ, при которой в его растворе возникает большое количество мицелл, находящихся в термодинамическом равновесии с его молекулами (ионами).
Методы определения ККМ основаны на регистрации резкого изменения физико-химических свойств растворов ПАВ в зависимости от концентрации (например, поверхностного натяжения, мутности, эквивалентной электропроводности, осмотического давления (Рис.4).
На кривой зависимости свойство-состав в области мицеллообразования обычно появляется излом. Одна из ветвей кривых (при более низких концентрациях) описывает свойства системы в молекулярном состоянии, а другая - в коллоидном. Абсциссу точки излома условно считают соответствующей переходу молекул в мицеллы, т.е. критической концентрации мицеллообразования.
Одним из основных характерных свойств мицеллярных растворов ПАВ является их солюбилизирующая способность, т.е. способность к растворению в мицеллах ПАВ веществ, практически нерастворимых в дисперсионной среде. Вещество, солюбилизированное раствором ПАВ, называют солюбилизатом, а ПАВ – солюбилизатором. Солюбилизацию следует рассматривать как своеобразное равновесное распределение солюбилизируемого вещества между макрофазой (дисперсионной средой) и коллоидной микрофазой (внутренней частью мицелл).
|
|
|
Солюбилизирующую способность растворов ПАВ характеризуют величиной,называемой молярной солюбилизацией при насыщении Sm:
Sm = (ns – nw)/(c – ck) моль/моль, (2.3)
где ns – полная растворимость солюбилизата, nw - его растворимость в воде, c – общая растворимость ПАВ в водном растворе, ck – ККМ ПАВ. Если растворимость солюбилизата в воде и ККМ очень малы, то Sm ≈ ns /c.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ.
1. Рассчитайте критическое значение межфазного натяжения, определяемого критерием Ребиндера, ниже которого происходит самопроизвольное диспергирование. Температура 20°С, размер образующихся частиц 10-8 м, логарифм отношения числа частиц дисперсной фазы к числу молекул дисперсионной среды равен γ = 15.
РЕШЕНИЕ Межфазное поверхностное натяжение, при котором происходит образование лиофильных дисперсных систем, вычисляется по соотношению Ребиндера – Щукина (2.2):
σкрит ≤ γ KT / a2
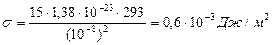
2. Методом кондуктометрии определена удельная электропроводность æ водного раствора лаурата натрия различных концентраций с. Определите графически ККМ ПАВ.
| c, кг/м3 | |||||||
| æ∙105, Ом-1∙м-1 | 0,5 | 0,77 | 1,27 | 1,67 | 2,43 | 3,2 |
 |
Рис. 5. Определение ККМ лаурата натрия.
РЕШЕНИЕ. По табличным данным строим график в координатах, указанных на рис. 2, и находим точку излома, соответствующую ККМ. Как следует из рис. 5, ККМ составляет 6 кг/м3.
|
|
|


