 |
Контрольные вопросы. Лекция 19. Биотехнология антибиотиков
|
|
|
|
Контрольные вопросы
1. Биологическая роль витаминов.
2. Продуценты витаминов.
3. Биотехнологическое производство витаминов, особенности процессов.
4. Микробиологический синтез витамина В2, В12.
5. Микробиологический синтез эргостерина.
Лекция 19
Биотехнология антибиотиков
Форма проведения лекции: обзорная
План лекции
1. Создание антибиотиков новых поколений: поиски новых штаммов-продуцентов; химическая модификация уже имеющихся антибиотиков; мутасинтез.
2. Классификация антибиотиков
3. Производство антибиотиков
1. Антибиотики – специфические продукты жизнедеятельности различных групп микроорганизмов, низших и высших растений и животных или их модификаций, обладающие высокой физиологической активностью в отношении определенных групп микроорганизмов или злокачественных опухолей, избирательно задерживающие их рост или подавляющие развитие.
Образование антибиотиков – наследственно закрепленная особенность метаболизма организмов. Это проявляется в том, что каждый вид (или даже штамм) способен образовывать один или несколько определенных, строго специфичных для него антибиотических веществ. Вместе с тем одинаковые антибиотики могут образовываться несколькими видами организмов (это свидетельство того, что данные микроорганизмы имеют общего предка). Образование антибиотика обусловлено определенным характером обмена веществ, возникающим и закрепленным в процессе эволюции организма. Эволюционное значение антибиотиков подчеркивается тем, что в антибиотикообразование может быть включено около 1% генов продуцента (род Streptomyces) и эта часть ДНК, несмотря на энергетические затраты при ее репликации, не теряется во время селекции в естественных условиях.
|
|
|
Образование антибиотиков – фактор биологический, имеющий адаптационное значение. Для продуцента способность образовывать антибиотики важна не постоянно, а лишь в неблагоприятных условиях, например, при истощении среды питательными компонентами, при контакте со специфическими продуктами жизнедеятельности другого организма.
Формы взаимодействия между организмами весьма разнообразны – от мирного сожительства до явного антагонизма. Типы связей внутри микробиологических сообществ подразделяют на трофические и метаболические. Трофические связи характерны для метабиоза (последовательное использование субстрата), когда продукты жизнедеятельности одного микроорганизма, содержащие значительное количество энергии, потребляют другие виды микроорганизмов в качестве питательного материала. Метаболические связи выстраиваются, когда одни микроорганизмы могут потреблять отдельные продукты метаболизма других микроорганизмов или продукты метаболизма являются их ингибиторами.
Тип связи определяет специфику взаимодействия организмов. Симбиотические взаимоотношения характеризуются тем, что различные виды микроорганизмов создают для себя взаимовыгодные условия. Например, совместное развитие аэробных и анаэробных микроорганизмов: развиваясь в аэробных условиях, микробы поглощают кислород, создавая благоприятные условия для развития анаэробов. Паразитизм – форма взаимоотношений, при которой некоторые микробы развиваются за счет веществ клетки других организмов, например бактерии. Паразиты бывают внеклеточные (риккетсии) и внутриклеточные (вирусы). Хищничество имеет место, когда некоторые микробы поглощают клетки организмов других видов, используя их в качестве источника питания (преимущественно продукты лизиса живых клеток других бактерий). К числу микроорганизмов-хищников относятся, главным образом, миксоформы (миксобактерии, миксоамебы, миксомицеты). Антагонизм – это условия, при которых один вид микроорганизмов угнетает или полностью подавляет рост и развитие других видов. Явление антагонизма широко распространено среди бактерий, актиномицетов, грибов и других микроорганизмов. Образование антибиотических веществ – специфическая особенность вида или даже штамма микроорганизмов, возникшая в результате их эволюционного развития как одна из приспособительных особенностей.
|
|
|
В естественных условиях четко ограниченных форм взаимоотношений не наблюдается. В процессе эволюции на разных этапах роста организмов и в зависимости от условий их развития один тип взаимодействия может смeниться другим. Так, ряд бактерий (E. coli, B. subtilis, B. cereus и др. ) образуют фермент пенициллиназу, разрушающий пенициллин, выделяемый Penicillium notatum, P. chrisogenum и мицелиальными грибами других видов.
Антибиотики – первые лекарственные средства, полученные биотехнологическим способом. С антибиотиками человечество сталкивается с древних времен. У же в Библии упоминается использование травы иссоп для лечения кожных заболеваний. Эта трава, как известно, поражается плесенью рода Penicillium или Aspergillus и может быть насыщена метаболитами грибов антибиотического характера.
Основные этапы развития производства антибиотиков
1870 г. - обнаружено, что в среде, содержащей плесень, бактерии не развиваются (Д. Сандерсон);
1872 г. - доказана способность Penicillium glaucum подавлять рост бактерий (Д. Листер);
1871-1872 гг. - показано, что молодая культура зеленой плесени - грибы рода Penicillium - способна задерживать развитие возбудителей ряда кожных заболеваний человека (В. А. Манассеин, А. Г. Полотебнов);
1877 г. - опубликовано сообщение о подавлении роста Bacillus anthracis аэробными бактериями (Л. Пастер и С. Джеберт, А. Г. Лебединский);
1929 г. - обнаружены антибиотические свойства грибов Penicillium (А. Флеминг);
1940 г. - выделена субстанция пенициллина (X. Флори, Е. Чейн);
1942-1956 гг. - коллектив ученых и практиков во главе с академиками Л. А. Зильбером и З. В. Ермольевой провели поиск и отбор штаммов-продуцентов; разработали ферментационные среды и первые регламенты промышленного производства бензилпенициллина. Сравнение двух штаммов (советского и английского) показало, что советский штамм образует 28 ед/мл, английский — 20 ед/мл.
|
|
|
Открытие и изучение свойств нового антибиотика, применяемого в медицинской или сельскохозяйственной практике, — это огромный труд ученых различных направлений (микробиологов, биохимиков, микологов, химиков, генетиков, фармакологов, биотехнологов, врачей).
Со времени открытия пенициллина из разных микроорганизмов были выделены более 6000 антибиотиков, обладающих разной специфичностью и разным механизмом действия. Их широкое применение для лечения инфекционных заболеваний помогло сохранить миллионы жизней.
Основные причины быстрого роста числа антибиотиков:
-многие антибиотические вещества или продукты их модификации являются незаменимыми ЛП при инфекционных заболеваниях, ранее считавшихся неизлечимыми;
- изменилась этиологическая структура инфекционных заболеваний, возросло число видов бактерий, их индуцирующих; широкое распространение получили инфекции, вызываемые грамотрицательными инфекциями, оттеснив стафилококковые заболевания;
- как лечебные средства антибиотики применяют в животноводстве, птицеводстве, пчеловодстве, растениеводстве; отдельные антибиотики являются стимуляторами роста животных;
- проблема резистентности микроорганизмов предполагает замену одних антибиотиков другими, более эффективными;
- некоторые антибиотики применяют в качестве консервантов в пищевой промышленности;
- развитие химии природных соединений (изучение структуры, их модификация и синтез) способствует появлению новых знаний об антибиотиках;
- антибиотики используют при изучении отдельных сторон метаболизма организмов, расшифровке тонких молекулярных механизмов биосинтеза белка, механизма функционировании мембран, специфических ингибиторов ферментов, в первую очередь, инактивирующие антибиотики.
|
|
|
Подавляющее большинство основных антибиотиков было выделено из грамотрицательной почвенной бактерии Streptomyces, хотя их продуцируют также грибы и другие грамположительные и грамотрицательные бактерии. Ежегодно во всем мире производится 100000 т антибиотиков на сумму около 5 млрд долларов, в том числе более 10 млн долларов приходится на долю антибиотиков, добавляемых в корм скоту в качестве пищевых добавок или ускорителей роста.
По оценкам ВОЗ каждый год ученые обнаруживают от 100 до 200 новых антибиотиков, прежде всего в рамках обширных исследовательских программ по поиску среди тысяч различных микроорганизмов таких, которые синтезировали бы уникальные антибиотики.
Получение, лабораторные и клинические испытания новых лекарственных средств обходятся дорого, до применения доходят только те из них, которые имеют большую терапевтическую ценность и представляют экономический интерес; на их долю приходится 1- 2 % всех обнаруживаемых антибиотиков.
Образование антибиотиков — наследственно закреплённая особенность метаболизма микроорганизмов, проявляющаяся в том, что каждый вид (или даже штамм) способен продуцировать один или несколько определенных, строго специфичных для него антибиотических веществ, что обусловлено определённым характером обмена, возникающим и закреплённым в процессе эволюции микроорганизма.
Метаболиты являются промежуточными продуктами обмена веществ, результатом катаболических и анаболических реакций; конечный продукт обмена - антибиотики - синтезируются из первичных метаболитов.
Специфичность антибиотиков характеризуется:
- высокой биологической активностью в отношении чувствительных к ним организмов, т. е. способностью проявлять эффект даже в очень низких концентрациях;
- избирательностью действия, т. е. способностью конкретного антибиотика проявлять свое действие лишь в отношении определенных организмов или групп организмов, не оказывая заметного эффекта на другие формы живых существ.
Величину биологической активности антибиотиков выражают в условных единицах, содержащихся в 1 мл (ед/мл) или в 1 мг (ед/мг) препарата. За единицу антибиотической активности принято минимальное количество антибиотика, способное подавить развитие или задержать рост определенного числа клеток стандартного штамма тест-микроба в единице объема питательной среды. Так, за единицу активности пенициллина приято минимальное количество препарата, способное задерживать рост золотистого стафилококка (штамм 209) в 50 мл питательного бульона; для стрептомицина единица активности - минимальное количество антибиотика, задерживающее рост Е. coli в 1 мл питательного бульона.
|
|
|
Угнетение роста микроорганизмов антибиотиками может осуществляться только при наличии трех условий:
- биологически важная для жизнедеятельности бактерий система должна реагировать на воздействие низких концентрацией препарата через определенную точку приложения;
- препараты должны обладать способностью проникать в бактериальную клетку и воздействовать на точку приложения;
- препарат не должен инактивироваться раньше, чем вступит во взаимодействие с биологически активной системой бактерии.
Точки приложения действия антибактериальных препаратов в бактериях различны - большая часть их находится в клеточной мембране и внутри клетки. Для достижения этих точек антибиотики сначала должны проникнуть через поверхностные слои клетки, находящиеся снаружи от цитоплазматической мембраны.
Главным барьером на этом пути препарата является клеточная стенка. В клеточной стенке грамположительных бактерий содержится большое количество мукопептидов, являющихся основной мишенью для антибиотиков.
Клеточная стенка грамотрицательных бактерий содержит большое количество липидов, в силу чего она менее проницаема и является надежным барьером для многих антибактериальных средств. Это обстоятельство служит причиной поиска новых антибиотиков (полусинтетические пенициллины и цефалоспорины), которые обладают хорошей проникающей способностью через липополисахаридный слой грамотрицательных бактерий и имеют высокую активность против большинства из них.
2. Сложилось несколько подходов к классификации антибиотиков:
- по принципу биологического происхождения (предпочтительна для биологов, изучающих организмы-продуценты антибиотических веществ);
- по химическому строению (удобна для химиков, занимающихся изучением строения молекул антибиотиков и путей из синтеза);
- по типу и механизму биологического действия (принята в медицинской практике).
Тип действия антибиотиков бывает цидным (бактерицидным, фун-гицидным, вирицидным, протозоацидным), под ним понимают необратимое нарушение жизнедеятельности (гибель) инфекционного агента, и статическим (бактериостатическим, фунгистатическим, виристатиче-ским, протозоостатическим), при котором прекращается или приостанавливается размножение возбудителя.
Такая градация имеет основное практическое значение при лечении тяжелых инфекций, особенно у пациентов с нарушениями иммунитета, когда обязательно назначение «цидных» препаратов.
Связь антимикробного препарата с точками приложения в микробной клетке может быть прочной или непрочной, что, в той или иной мере, определяет степень активности данного препарата.
Антибиотики должны обладать высокой избирательной токсичностью, т. е. они должны быть активны по отношению к микробным клеткам и безвредны для клеток больного организма.
Подобная избирательная токсичность может быть реализована лишь в том случае, если активные биохимические системы микробных клеток — мишени антибиотиков — отличны от подобных систем клеток макроорганизма.
Селективная токсичность может носить пограничный характер, когда отличия в биохимических структурах клеток организма человека и бактерии заключаются в различном положении фосфолипидов в цитоплазматической мембране.
Проблема селективности антибиотиков сложнее по причине того, что для репликации вирусы используют ферменты клеток хозяина.
В зависимости от точки приложения и механизма биологического действия антибиотики делят на:
I. Специфические ингибиторы биосинтеза клеточной стенки (пе-нициллины, цефалоспорины и цефамицины, ванкомицин, ристомицин, циклосерин, бацитрацин, тиенамицины и др. )
II. Препараты, нарушающие молекулярную организацию и функции клеточных мембран (полимиксины, полиены).
III. Препараты, подавляющие синтез белка на уровне рибосом (макролиды, линкомицины, аминогликозиды, тетрациклины, левомицетин, фузидин).
IV. Ингибиторы синтеза РНК на уровне РНК-полимеразы и ингибиторы, действующие на метаболизм фолиевой кислоты (рифампицины).
V. Ингибиторы синтеза РНК на уровне ДНК-матрицы (актиномицины, антибиотики группы ауреоловой кислоты).
VI. Ингибиторы синтеза ДНК на уровне ДНК-матрицы (митомицин С, антрациклины, нитрофураны, налидиксовая кислота).
При выделенном возбудителе назначают антибиотики с максимально узким спектром активности, так как «избыточная» широта спектра не дает преимуществ и опасна с точки зрения подавления нормальной микрофлоры.
Общая стратегия рекомбинантных микроорганизмов, способных синтезировать антибиотики, состоит во введении в организм хозяина специфических генов, клонированных в подходящем векторе, которые кодируют один или несколько ферментов, катализирующих не свойственные микроорганизму метаболические реакции, или генов, влияющих на осуществляемый им в норме биосинтез определенных соединений.
При создании рекомбинантных штаммов Streptomyces - основного микроорганизма, используемого для получения антибиотиков, важно, чтобы трансформация и отбор трансформированных клеток не должны быть слишком сложны. В отличие от Е. coli, Streptomyces существуют не в виде изолированных клеток, а в виде протяженных мицелл, поэтому перед трансформацией необходимо ферментативное разрушение клеточной стенки мицелл и высвобождение отдельных протопластов.
Без этого невозможно отличить трансформированные клетки от нетрансформированных, поскольку видимые колонии на твердой среде будут образовываться из группы клеток, а не из индивидуальной клетки. Соответственно колонии, растущие в присутствии селективного антибиотика, будут представлять собой смесь трансформированных и нетрансформированных клеток.
Проникновение плазмидной ДНК в протопласты Streptomyces облегчается в присутствии ПЭГ. После трансформации протопласты высевают на твердую среду, чтобы образовалась клеточная стенка, а затем для отбора трансформированных клеток переносят на селективную среду, обычно содержащую неомицин, где образуется колония, выросшая из трансформированных клеток, способных синтезировать антибиотик.
С помощью генетических или биохимических экспериментов можно идентифицировать, затем выделить один или несколько ключевых ферментов биосинтеза антибиотиков, определить их N-концевые аминокислотные последовательности и, исходя из этих данных, синтезировать олигонуклеотидные комплементарные последовательности.
3. Технологический процесс производства антибиотиков представлен на рисунке 5.
Биосинтез антибиотика осуществляется микроорганизмами на определённом этапе их развития. Эта закономерность характерна для бактерий, мицелиальных грибов (Penicillium chrysogenum, Aspergillus fumigatus и др. ) и для большинства актиномицетов, образующих такие антибиотики, как стрептомицин, хлортетрациклин, окситетрациклин и другие.
Максимально высокую активность штамма-продуцента способна обеспечить технология рекомбинантных ДНК, так как можно создавать новые антибиотики с уникальной структурой, оказывающие более мощное воздействие на определенные микроорганизмы и обладающие минимальными побочными эффектами. Генно-инженерные подходы используются для увеличения выхода антибиотиков и соответственно снижения стоимости их производства.
Примеры промышленных продуцентов основных антибиотиков, используемые в РФ, представлены в таблице 2.
При проведении первой стадии технологического процесса (рис. 7) применяют натуральные среды неопределенного состава, к числу которых относят продукты крахмалопаточного производства, агар, желатин, отруби, зерно. Композиция натуральных сред неопределенного состава не является постоянной. Например, агар, получаемый из разных видов морских водорослей, по химическому составу — сложный эфирный комплекс полисахарида с серной кислотой и разнообразными микроэлементами. Агар содержит также жирные кислоты, биотин, тиамин или его компоненты. В картофельной среде с глюкозой и пептоном, при одной и той же партии пептона и химически чистой глюкозы, состав картофельного экстракта зависит от сорта картофеля, места его произрастания, времени уборки, срока и режима хранения и других причин. Поэтому для получения сопоставимых результатов, особенно при изучении физиологических и биохимических особенностей микроорганизма, применяют синтетические среды, в состав которых входят определенные химически чистые соединения, взятые в точно указанных концентрациях.
Задача второй стадии - создать оптимальные условия для развития продуцента и максимально возможного биосинтеза необходимого антибиотика. Особенность производства антибиотиков - двухфазный характер развития продуцентов.
В первой фазе развития культуры, носящей название тропофазы (фазы сбалансированного роста микроорганизма), идет интенсивное накопление биомассы продуцента. Продуцент синтезирует белки, нуклеиновые кислоты, углеводы, ферменты, и другие БАВ, необходимые для роста микроорганизма; наблюдается быстрое потребление основных компонентов субстрата, интенсивное поглощение кислорода. В культуральной среде может снижаться рН, как результат накопления органических кислот. В тропофазе антибиотик, как правило, не образуется или его количество незначительное. Возможно, в этой фазе синтез ферментов, принимающих участие в образовании антибиотика, подавлен.
Во второй фазе — идиофазе (фазе несбалансированного роста микроорганизма) - накопление биомассы замедлено. Культуральная среда уже обеднена компонентами, необходимыми для развития продуцента и обогащена продуктами его жизнедеятельности. В культуре преобладают протеолитические процессы, приводящие к её подщелачиванию. Продукты метаболизма микроорганизма частично используются на построение клеток мицелия, частично - на синтез антибиотика. Максимум биосинтеза антибиотика в культуральной среде наступает, как правило, после максимального накопления биомассы, этот максимум неодинаков у разных микроорганизмов и при разных условиях культивирования. Практика промышленной микробиологии показывает, что процесс получения того или иного продукта жизнедеятельности активнее идет в смешанных культурах, при совместном развитии нескольких видов (чаще двух) микроорганизмов.
Совместным культивированием специально подобранных микроорганизмов создают условия, при которых значительно увеличивается образование антибиотиков, как результат активации ряда биохимических процессов. В смешанных культурах ферментативная реакция служит ответом на проявление определенных антагонистических взаимоотношений. При совместном культивировании различных микробов могут возникать своеобразные гибриды этих организмов, обладающие иными свойствами по сравнению с исходными чистыми культурами. С накоплением определенной концентрации антибиотика рост микроорганизмов прекращается (например, Streptomyces griseus прекращает свой рост при концентрации в среде стрептомицина сульфата 0, 5%). Из культуральной среды антибиотики выделяют экстракцией органическими растворителями, осаждением, адсорбцией. Очистку антибиотиков проводят повторной заменой растворителя, адсорбционно-хроматографическими методами, ВЭЖХ.
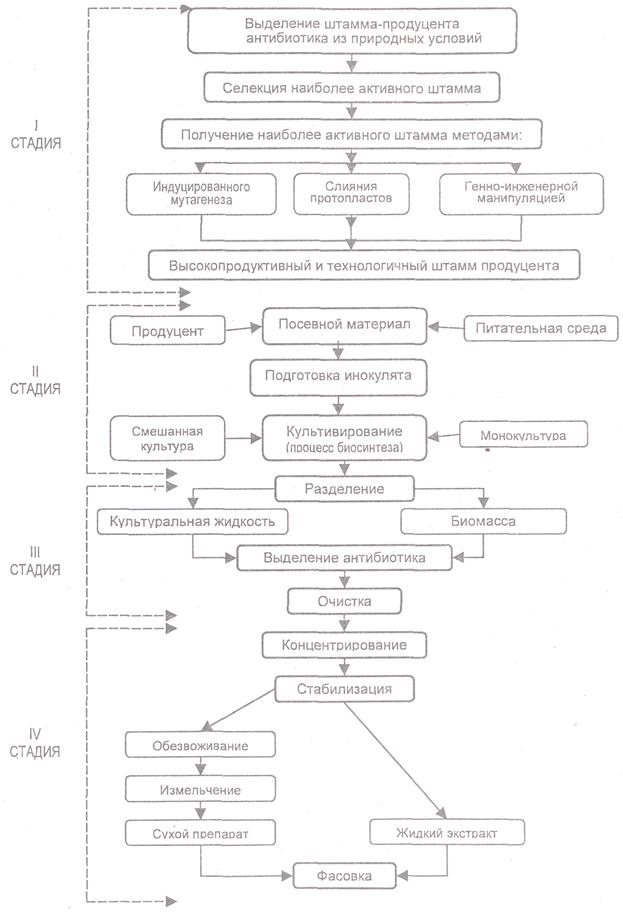 Рисунок 7. Схема производства антибиотиков в процессе микробного
Рисунок 7. Схема производства антибиотиков в процессе микробного
биосинтеза (по Н. Е. Егорову)
Таблица 2. Промышленные продуценты антибиотиков
| Антибиотик | Продуцент |
| Антибиотики, образуемые бактериями | |
| 1. Грамицидин С | Bacillus brevis |
| 2. Полимиксины | Bacillus polymyxa |
| 3. Бацитрацины | Bacillus licheniformis и В. erevis |
| 4. Низин | Streptococcus lactis |
| Антибиотики, образуемые актиномицетами | |
| 1. Стрептомицин | Streptomyces griseus |
| 2. Неомицин | Streptomyces fradiae |
| 3. Канамицин | Streptomyces kanamyceticus |
| 4. Гентамицин | Micromonospora purpurea |
| 5. Сизомицин | Micromonospora inyoensis |
| 6. Тобрамицин | Streptomyces tenebraris |
| 7. Хлортетрациклин | Streptomyces aureofaciens |
| 8. Окситетрациклин | Streptomyces rimosus |
| 9. Амфотерецин В | Streptomyces noolosus |
| 10. Тетерациклин | Streptomyces aureofaciens |
| 11. Хлорамфеникол | Streptomyces venezuelae |
| 12. Эритромицин | Saccharopolyspora erythraea |
| 13. Спирамицин | Streptomyces ambofaciens |
| 14. Тилозин | Streptomyces fradiae |
| 15. Нистатин | Streptomyces noursei |
| 16. Леворин | Streptomyces levoris |
| Антибиотики, образуемые грибами | |
| 1. Пенициллины | Penicillium chrysogenum |
| 2. Цефалоспорин | Cepholosporium acremonium |
| 3. Циклоспорин | Trichoderma polysporum |
| 4. Гризеофулызин | Penicillium griseofulvum |
| 5. Фузидин | Fusidium coccineum |
|
|
|


