 |
Обратимые (двусторонние) реакции первого порядка
|
|
|
|
Обратимые реакции могут быть I и II порядка 
Обратимая реакция идет до равновесия в течении 
 | |||||
 | |||||
 | |||||
- равновесные концентрации
Суммарная скорость реакции равна
 (1.43)
(1.43)
разности прямой и обратной реакций
В любой момент времени

 (1.44)
(1.44)
 (1.45)
(1.45)

 (1.46)
(1.46)

При  , const = - ln L
, const = - ln L
Тогда уравнение (1.46) можно записать


 (1.47)
(1.47)
Уравнение (1.47) позволяет найти сумму (k1 + k2), но не дает возможности найти k1 и k2. Найти значение k1 и k2 можно, исходя из равновесия прямой и обратной реакции, когда  , т.е.
, т.е. 

Константа равновесия реакции
 (1.48)
(1.48)
Преобразуем выражение L, поделив на k2:


 (1.49)
(1.49)
Исходя из выражения L уравнения (1.50) можно записать
 совместное решение этих (1.50)
совместное решение этих (1.50)
двух уравнений позволяет найти значение k1 и k2



Параллельные односторонние реакции
Реакции называются параллельными, если в каждой реакции в качестве исходного принимает участие одно и тоже вещество. Эти реакции могут быть I и II порядка.
 Рассмотрим параллельную реакцию I порядка, характерную для органического синтеза. Каждая реакция дает свой продукт.
Рассмотрим параллельную реакцию I порядка, характерную для органического синтеза. Каждая реакция дает свой продукт.

| 
| |||

| 
| 
| ||

| 
| 
| 
| 
|

|
Скорость параллельной реакции равна
 (1.51)
(1.51)

 (1.52)
(1.52)

Разделим переменные и проинтегрируем

При 
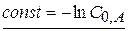
 (1.53)
(1.53)
 (1.54)
(1.54)


 (1.55)
(1.55)

Односторонние последовательные реакции
Реакции считаются последовательными, если вещество, образующееся в одной реакции, является исходным для другой. Реакции часто встречаются на практике и могут быть моно-, би- или тримолекулярными, односторонними или обратимыми.
Рассмотрим последовательную одностороннюю реакцию первого порядка

| |||

| 
| ||

| 
| 
| 
|
В – промежуточное вещество
|
|
|
К любому времени 

Составим кинетические уравнения для каждой стадии такой реакции
 система дифференциалов кинетических уравнений
система дифференциалов кинетических уравнений
Для I стадии реакции:
 (реакция I порядка)
(реакция I порядка)
 или
или  (1.56)
(1.56)
 (1.57)
(1.57)
Для второй стадии реакции:
 , проведя интегрирование получаем
, проведя интегрирование получаем
 (1.58)
(1.58)
y =  (1.59)
(1.59)
(x-y) =  - концентрация промежуточного вещества B ко времени τ.
- концентрация промежуточного вещества B ко времени τ.
Анализ развития последовательной реакции



Одной из особенностей последовательных реакций является наличие на графике  индукционного периода, когда конечный продукт почти не обнаруживается. Кривая в начальный период почти сливается с горизонтальной осью.
индукционного периода, когда конечный продукт почти не обнаруживается. Кривая в начальный период почти сливается с горизонтальной осью.
1) на кривой зависимости  имеется max, соответствующий τmax. Как видно из рисунка в момент max образования промежуточного вещества (B) наблюдается перегиб на кривой зависимости
имеется max, соответствующий τmax. Как видно из рисунка в момент max образования промежуточного вещества (B) наблюдается перегиб на кривой зависимости  или y = f(τ)
или y = f(τ)
Рассчитаем значение τmax. Когда (x-y) = max, производная равна 0.
(x-y) = 

0 = 

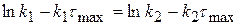

 (1.60)
(1.60)
2) Найдем, чему будет равно  , для этого в уравнение подставим значение τmax:
, для этого в уравнение подставим значение τmax:
 поделим на k1
поделим на k1

 (1.61)
(1.61)
Как видно из уравнения (1.61) max количество промежуточного вещества (B) не зависит от абсолютного значения констант k2 и k1, а определяется только их соотношением. С увеличением соотношения γ = 
 снижается.
снижается.
3) Рассмотрим 2 случая, когда γ1 =  = 2 и γ2 =
= 2 и γ2 =  = 10
= 10

При γ2 = 10, во втором случае, промежуточное вещество будет превращаться значительно быстрее чем возникать (k2 >> k1), его можно не заметить 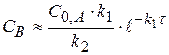 (1.62)
(1.62)
Если k1 >> k2, то скорость возникновения промежуточного продукта выше, чем его расходование.  (1.63)
(1.63)
Зависимость скорости химической реакции от температуры.
Уравнение Аррениуса.
Скорость химической реакции зависит не только от концентрации реагентов, но и от температуры. По правилу Вант-Гоффа увеличение температуры на 10о приводит к увеличению скорости реакции в 2-4 раза.
 - температурный коэффициент скорости химической реакции
- температурный коэффициент скорости химической реакции
|
|
|
Более строгая зависимость k от T выражается уравнением Аррениуса:
 (1.64)
(1.64)
где A и B – const; A – предэкспоненциальный множитель, B=  ;
;
 - энергия активации химической реакции
- энергия активации химической реакции

Другая запись уравнения Аррениуса:
 (1.65)
(1.65)
 , а зависит от природы реакции. Пользуясь этим уравнением можно определить энергию активации, если известны k при различных температурах.
, а зависит от природы реакции. Пользуясь этим уравнением можно определить энергию активации, если известны k при различных температурах.
 обычно > 0 и равна 50-500 Дж/моль,
обычно > 0 и равна 50-500 Дж/моль,  < 0 реже.
< 0 реже.
Для газофазных реакций A = 1012 -1016 C -1
 - величина потенциального барьера.
- величина потенциального барьера.
 находят часто графическим решением уравнения Аррениуса:
находят часто графическим решением уравнения Аррениуса:



 (1.66)
(1.66)
Строят график в координатах


 (1.67)
(1.67)
 < 0;
< 0;  = -R
= -R  ;
;  > 0
> 0
 можно рассчитать аналитически, зная значение константы скорости реакции при двух различных температурах.
можно рассчитать аналитически, зная значение константы скорости реакции при двух различных температурах.



 =
=  (1.68)
(1.68)
|
|
|


