 |
Зависимость молярной электропроводимости от температуры
|
|
|
|
Изменение электропроводимости раствора проводят в термостате, т.к. она в сильной степени зависит от температуры. Это связано:
1. С изменением вязкости среды (стоксовское сопротивление среды движению ионов). С увеличением температуры вязкость уменьшается, скорость иона возрастает.
2. С уменьшением степени гидратации (сольватации) ионов с повышением Т, при этом увеличивается подвижность ионов.
3. В области 70-1000С резко уменьшается диэлектрическая постоянная воды, → резко уменьшается диссоциация воды а, следовательно, и электропроводимость.
 (2.37)
(2.37)
Где V – разведение электролита (V =1/c)
При кондуктометрическом титровании растворов электролитов точка эквивалентности определятся по излому кривой зависимости электрической проводимости титруемого раствора от количества титранта. Резкое изменение электрической проводимости происходит при образовании в процессе титрования малодиссоциируемых и трудно растворимых соединений.
Рассмотрим некоторые примеры:
1. Титрование сильной кислоты щелочью

а) При растворении в воде HCI диссоциирует HCI + H2O ⇆ H3O+ + CI- подвижность H3O+ больше в 7 раз подвижностей остальных ионов, æ=æmax (λ=λmax)
б) При добавлении NaOH
H3O+ + OH- = 2H2O
 количество ионов H3O+ уменьшается, электропроводность снижается до точки эквивалентности.
количество ионов H3O+ уменьшается, электропроводность снижается до точки эквивалентности.
в) В точке эквивалентности нет ионов H3O+ и OH-, есть только ионы Na+ и CI-, самая низкая электропроводимость.
г) После точки эквивалентности накапливаются гидроксид ионы (OH-) электропроводимость опять возрастает. 

Если вместо NaOH взять любую щелочь (NH4OH), α =10-2, то линия после точки эвтектики пойдет ниже
NH4OH ⇆ NH4+ + OH-
NH4OH + H3O+ = 2H2O + NH4+
2. Титрование слабой кислоты щелочью.
|
|
|
Муравьиная кислота – HCOOH
HCOOH + NaOH ⇆ H3O+ + HCOONa + H2O
а) HCOOH + H2O ⇆ H3O+ + HCOO- - плохая диссоциация - плохая электропроводность.
б) HCOOH + Na+ + OH- = H2O + HCOO- + Na+ - слабое возрастание электропроводимости за счет Na+ и СH3COO-
в) в точке эквивалентности 
 г) NaOH избыток, возрастание электропроводимости за счет и OH- - ионов.
г) NaOH избыток, возрастание электропроводимости за счет и OH- - ионов.
3. Титрование смеси двух кислот.
Вначале титруется сильная кислота, а затем слабая кислота. Например, смесь HCI + HCOOH.
V1 – объем, пошедший на титрование HCI
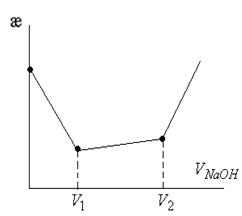 (V2‒V1) – объем щелочи, пошедший на титрование HCOOH.
(V2‒V1) – объем щелочи, пошедший на титрование HCOOH.
СNaOH V1 = Vпробы CHCI
CHCI = 
СHCOOH = 
4. Титрование смеси кислоты и соли
Смесь: H2SO4 + CuSO4
Первый участок титрования: H2SO4 + 2NaOH
V1 – объем пошедший на титрование H2SO4
H3O++SO42-+2Na++2OH-=2Na++SO42-+2H2O
Второй участок титрования: CuSO4+2NaOH→Cu(OH)2+2Na++SO42-
Электропроводность практически не меняется, т.к. ионы (Cu2++SO42-) заменяются на (2Na++SO42-).
Третий участок титрования: накопление гидроксид ионов, электропроводность возрастает.
 Кондуктометрическое титрование широко применяется при титровании мутных и окрашенных растворов, где обычным объемным методом титрования сложно по изменению окраски в присутствии индикаторов определить точку эквивалентности, а также для титрования многокомпонентных смесей. Электрохимические методы титрования более точные.
Кондуктометрическое титрование широко применяется при титровании мутных и окрашенных растворов, где обычным объемным методом титрования сложно по изменению окраски в присутствии индикаторов определить точку эквивалентности, а также для титрования многокомпонентных смесей. Электрохимические методы титрования более точные.
Ионные равновесия в растворах электролитов
Термодинамическая константа диссоциации
Растворов электролитов
Константа равновесия любого химического процесса, в том числе и диссоциации, выраженная через активность, записывается следующим образом:
 (2.38)
(2.38)
Из уравнения изотермы химической реакции активность иона  .
. 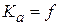 (Т, природы растворителя).
(Т, природы растворителя).
Для примера рассмотрим диссоциацию одноосновной кислоты в водном растворе:
HA + H2O ⇆ H3O+ + A-
Протон Н+ в природе не существует, в водных растворах он всегда гидратирован молекулами и существует в виде иона гидроксония.
|
|
|
 (2.39)
(2.39)
Обычно в растворах С0,1≫С0,2, т.е. концентрация растворителя значительно больше концентрации растворенного вещества.
 (2.40)
(2.40)

Кдисс включает в себя произведение Кравн. на активность воды.
 (2.41)
(2.41)
Перегруппируем
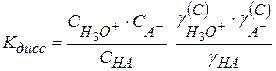 (2.42)
(2.42)
Активности катиона и аниона определить невозможно; активность молекулярной формы принято считать равной единице.
Тогда
 (2.43)
(2.43)
Известно, что

Для одноосновной кислоты

С учетом этого
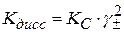 (2.44)
(2.44)
Кс – концентрационная константа диссоциации, которая зависит от С, Т и природы растворителя. Выразим Кс через степень электролитической диссоциации α:
НА +Н2О ⇆ Н3О+ +А⁻

Степень диссоциации электролита
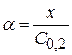
Отсюда
 - это уравнение является законом разведения Оствальда.
- это уравнение является законом разведения Оствальда.
Значение константы Кс можно определить экспериментальным путем по значению α:

λ ∞ рассчитывают по уравнению Кольрауша:

 определяется кондуктометрическим методом.
определяется кондуктометрическим методом.
Прологарифмируем уравнение (2.44)
 (2.45)
(2.45)
Значение  определяют по уравнению Дебая-Хюккеля:
определяют по уравнению Дебая-Хюккеля:
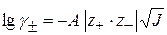
Для НА  , тогда
, тогда 



или
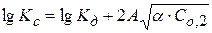
Рассчитав ионную силу раствора и экспериментально определив Kc, можно найти величину Кдисс .
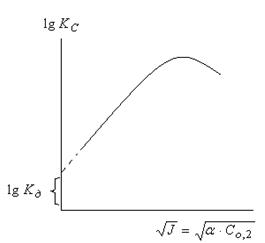
Найденная константа Кдисс . экстраполирована на нулевую точку, при которой J =0
Кдисс.=f (Т,Р, природа растворителя)
Kc =f (Р,Т,С, природа растворителя), т.е. Кдисс.≠ f(C)
В справочниках приводятся значения рК=−lg Кдисс .
Для кислот – рКa (или рКА)
Для оснований рКв (или рКВ)
рКА или рКВ – показатель константы диссоциации кислоты и основания.
Если рК = 9÷16 – очень слабые электролиты,
рК = 3÷9 – слабые электролиты,
рК ≤ 3 – умеренно слабые электролиты.
Кислотно-основная теория Бренстеда
Теория Аррениуса широко применяется к трактовке различных кислотно-основных равновесий или протолитических равновесий. Согласно этой теории кислотой (НА) является соединение, диссоциирующее на протоны Н+ и кислотный остаток:
НА ⇆ Н+ + А−,
а основанием является соединение, диссоциирующее на катионы металла и ионы гидроксила:
ВОН ⇆ В+ + ОН-
Более широкую практику кислотно-основных равновесий дает теория Бренстеда. Согласно этой теории кислота – донор протона, основание − акцептор протона. При протолитическом равновесии образуются кислотно-основные пары.
|
|
|
Например, в реакции (диссоциация)
HCI + H2O ⇆ H3O+ + CI-
молекула HCI – кислота, H2O – основание.
В определенных условиях ион Н3О+ может отдать CI- - иону протон. В этом случае H3O+ - кислота, а ион CI- - основание, сопряженное с HCI.
Н3О+ + CI- → HCI + H2O
Одно и тоже вещество в определенных условиях может проявлять кислотные или основные свойства.
Например, уксусная кислота является кислотой по отношению к воде и основанием по отношению к более сильной серной кислоте, принимая от нее протон.
|
|
|


