 |
Каталитическая активность и избирательность
|
|
|
|
Мерой каталитической активности A является изменение скорости химической реакции в результате введения kt:
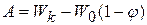 (1.95)
(1.95)
где 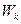 и
и  - скорости реакции в присутствии kt и без него;
- скорости реакции в присутствии kt и без него;
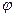 - доля объема системы, занимаемой kt и недоступная для реагирующих веществ.
- доля объема системы, занимаемой kt и недоступная для реагирующих веществ.
A может быть (+) и (-) в соответствии с положительным и отрицательным катализом. Часто  очень мал, то им можно пренебречь, поэтому
очень мал, то им можно пренебречь, поэтому
 (1.96)
(1.96)
Если реакция протекает вблизи равновесия и является двусторонней, то за меру каталитической активности принимают скорость протекания реакции в прямом направлении.
Удельная каталитическая активность относится к единице количества kt(a). В гомогенном катализе относится к числу молей в единице объема:
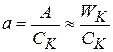 ;
; 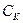 - концентрация kt в системе
- концентрация kt в системе
В гетерогенном катализе
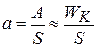 ;
;  - площадь поверхности kt
- площадь поверхности kt
При использовании однотипных катализаторов для данной реакции
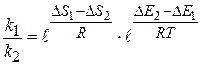
Для однотипных катализаторов 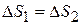 , тогда
, тогда
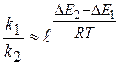 (1.97)
(1.97)
Данное сравнение скоростей и каталитической активности можно делать в случае, когда для обоих kt реакция идет по одному механизму. Говорят о каталитической активности всей системы, включая реакционную смесь и kt (Г.К. Боресков)
Избирательностью kt называют его способность ускорять один из возможных путей реакции, если она может протекать по разным направлениям с образованием различных продуктов.
Свойство избирательности или селективности имеет большое практическое значение. Путем подбора соответствующих kt можно увеличить выход нужного продукта.
Например: при термическом разложении в газовой фазе диэтилового эфира без kt идет реакция
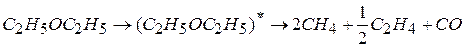
В присутствии паров  реакция идет быстрее в другом направлении
реакция идет быстрее в другом направлении

В присутствии kt может протекать и реакция, которая шла без kt, но скорость ее обычно ниже. Иногда для уменьшения скорости некаталитической реакции понижают температуру.
|
|
|
Кислотно-основной катализ
Для неводных растворов неприменимы обычные представления о кислотах и щелочах. Согласно обобщенной теории протолитического равновесия Бренстеда:
кислота – химическое соединение, способное в течении реакции отдавать протон – донор протонов;
Реакция присоединения протона – протонизация. Соединения 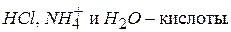
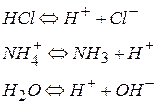
Основание – химическое соединение, способное присоединять протон – акцептор протона
Отнятие протона – депротонизация

В отщепление или присоединении протона участвует пара сопряженных кислоты и основания.

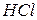 и
и  - сопряженные кислота и основание.
- сопряженные кислота и основание.
Одно и тоже вещество может выступать в роли кислоты и основания. Например, анилин в воде отнимает протон от молекулы воды и выступает как основание.

В жидком аммиаке (как растворителе) анилин является кислотой, отдает протон

Кислотно-основной катализ - наиболее распространенный и практически важный вид гомогенного катализа.
При кислотно-основном катализе две основных стадии:
при кислотном катализе:
1. протолитическая реакция и протонизация исходного вещества S за счет передачи протона от kt – кислоты AH;
2. катализатор – кислота регенерируется после образования продуктов реакции P и Q
для мономолекулярной реакции

В кислотном катализе kt может быть любое вещество, способное отщеплять протон (ион 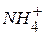 - соль
- соль 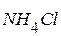 )
)
при основном катализе:
1 стадия – протолитическая реакция между исходным веществом SH и основанием B – депротонизация исходного вещества или передача протона kt -основанию
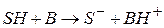
2 стадия – депротонизированная форма исходного вещества распадается с образованием продуктов P и Q и регенерацией kt
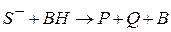
kt – любое вещество, присоединяющее протон; например: ион 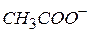 (соль
(соль  )
)
Лимитирующей стадией кислотно-основного катализа может быть первая или вторая стадия.
|
|
|
Рассмотрим кислотный катализ, когда первая стадия – протонизация близка к равновесному процессу, вторая – лимитирующая:
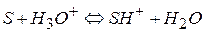 (I)
(I)
 (II) – лимитирующая
(II) – лимитирующая
Вторая стадия протекает по кинетическому уравнению реакции I порядка. Скорость реакции определяется по скорости II лимитирующей стадии:

где k – истинная константа скорости кислотно-каталитического превращения
Равновесная концентрация протонной формы вещества  составляет долю от общей концентрации
составляет долю от общей концентрации 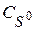 вещества S в растворе:
вещества S в растворе:

Тогда  (1.98)
(1.98)
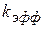 - эффективная константа скорости катализа
- эффективная константа скорости катализа
Зависимость k от  должно быть линейной.
должно быть линейной.
Выразим долю α:
Для I равновесной стадии
 ;
;  - константа кислотности вещества S
- константа кислотности вещества S
Учитывая, что 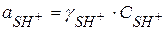
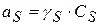
После небольших преобразований получим
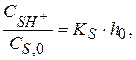 где
где 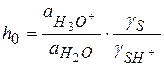
Величину  называют кислотностью среды, она характеризует способность отдавать протон.
называют кислотностью среды, она характеризует способность отдавать протон.
В разбавленных растворах  и
и  отсюда
отсюда
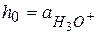 и
и 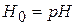 ;
; 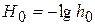 - функция кислотности Гамета
- функция кислотности Гамета
В концентрированных растворах кислот значения  и
и 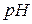 отличаются на несколько порядков, поэтому в концентрированных растворах нужно пользоваться понятиями кислотности среды и функции кислотности
отличаются на несколько порядков, поэтому в концентрированных растворах нужно пользоваться понятиями кислотности среды и функции кислотности  вместо
вместо  и
и 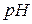
Общая концентрация вещества в растворе
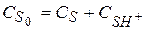
Вычислим 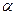 и
и 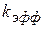 :
:

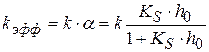 (1.99)
(1.99)
Анализ уравнения:

1) если 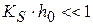 и
и 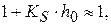
то 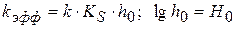
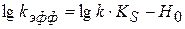
Зависимость  от
от  носит линейный характер. По этой зависимости графически определяется
носит линейный характер. По этой зависимости графически определяется  . По известному значению
. По известному значению  находят k.
находят k.
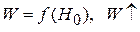 с
с 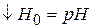
2) если  и
и  , то
, то 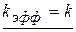
Опытное значение 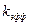 не должно зависеть от константы кислотности
не должно зависеть от константы кислотности  и
и 
3) если  , можно уравнение записать в следующем виде
, можно уравнение записать в следующем виде
 (1.100)
(1.100)
 носит линейный характер, графически определяем k и KS
носит линейный характер, графически определяем k и KS
При кислотно-основном катализе, когда I стадия считается лимитирующей (протонизация), согласно дуалистической теории кислотно-основного катализа Даусона при расчете скорости каталитического процесса необходимо учитывать, что каталитически активными центрами являются ионы гидроксония и гидроксила, а также молекулы недиссоциируемых кислот и оснований, недиссоциируемые молекулы воды.
Скорость реакции равна сумме всех скоростей реакции, обусловленных всеми катализирующими частицами:
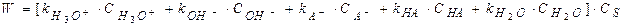
Где 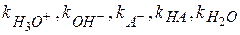 - константы скорости параллельных реакций;
- константы скорости параллельных реакций;
 - концентрация катализаторов.
- концентрация катализаторов.
При добавлении к раствору соли MA, скорость реакции возрастает за счет слагаемого  . Этот эффект называется вторичным солевым эффектом.
. Этот эффект называется вторичным солевым эффектом.
|
|
|
|
|
|


