 |
Молярная электрическая проводимость
|
|
|
|
Молярная электрическая проводимость - эта мера электрической проводимости всех ионов, образующихся при диссоциации 1 моля электролита при расстоянии 1м между параллельными электродами. Для одновалентных электролитов мольная электропроводимость (λ) равна эквивалентной электропроводимости (λэ). 
Для 1-2 валентных электролитов 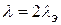 , (CdCI2, H2SO4).
, (CdCI2, H2SO4).
Для 1-3 валентных электролитов  .
.
Между молярной и удельной электрической проводимостью имеется соотношение
 (2.26)
(2.26)
где
λ – молярная электрическая проводимость  ,
,
V – разведение раствора, м3/моль
с – концентрация, моль/м3.
Если концентрация раствора выражена в моль/л, то
 (2.27)
(2.27)
С учетом, что  , следует
, следует

 (2.28)
(2.28)
Значение молярной электропроводимости зависит от концентрации электролита
Зависимость молярной электрической проводимости от концентрации для сильных (1) и слабых (2) электролитов.
С увеличением разведения молярная электропроводимость возрастает и в области больших разведений стремится к предельному значению  , тогда
, тогда
 (2.29)
(2.29)
Произведение  называется предельной электрической проводимостью ионов (
называется предельной электрической проводимостью ионов (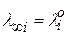 - иногда обозначают так).
- иногда обозначают так).
Тогда
 (2.30)
(2.30)
Гипотетический бесконечно разбавленный раствор характеризуется полной диссоциацией электролита и отсутствием электростатических сил.
λ ∞ - это сумма двух независимых слагаемых.
Закон независимого движения ионов Кольрауша:
 (2.31)
(2.31)
λ ∞ иона= f (Т, природа иона и растворителя)
Соотношение
 , (2.32)
, (2.32)
где  – коэффициент электрической проводимости
– коэффициент электрической проводимости
В разбавленных растворах  =1, отсюда
=1, отсюда
 (2.33)
(2.33)
Для сильных электролитов, когда α = 1
 (2.34)
(2.34)
Теория электролитической проводимости растворов Дебая - Онзагера:
Снижение молярной электрической проводимости при переходе от разбавленных растворов к концентрированным растворам связано с уменьшением скорости движения ионов за счет: 1) эффекта электрофоретического торможения, обусловленного электростатическим взаимодействием между ионом и его ионной сферой; 2) эффектом релаксационного торможения (нарушение симметрии иона).
|
|
|
По теории Онзагера  ; для 1,1 – валентного электролита
; для 1,1 – валентного электролита
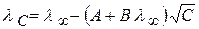 (2.35)
(2.35)
где А и В – константы, полученные с учетом сил релаксационного и электрофоретического торможения.
Молярная электрическая проводимость ионов
Гидроксония и гидроксида
В водных растворах протон (ион) водорода записывают в виде иона гидроксония – H3O+
H+ + H2O ⇆ H3O+
Ионы H3O+ и гидроксида OH− обладают более высокой молярной электрической проводимостью или подвижностью, чем другие ионы.
Подвижности большинства катионов и анионов лежат в пределах (40-80) 10-4  . Значение предельной подвижности, например, иона натрия
. Значение предельной подвижности, например, иона натрия 
 , а иона хлора
, а иона хлора 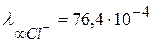
 .
.
Значение предельной подвижности иона гидроксония 
 . Это позволяет предполагать, что наряду с миграцией ионам H3O+ и OH- свойственен и другой механизм перемещения в электрическом поле. Аномально высокая подвижность ионов H3O+ и OH- объясняется эстафетным механизмом перемещения ионов, сущность которого заключается в следующем:
. Это позволяет предполагать, что наряду с миграцией ионам H3O+ и OH- свойственен и другой механизм перемещения в электрическом поле. Аномально высокая подвижность ионов H3O+ и OH- объясняется эстафетным механизмом перемещения ионов, сущность которого заключается в следующем:
1. При наложении электрического поля переход протона от H3O+ к молекуле воды повышается в направлении поля. Передвижение протона совершается по цепочке от одной молекулы воды к другой по схеме:

Электричество переносится мигрирующими ионами H3O+ и протонами.
2. Аналогичным образом объясняется подвижность ионов гидроксида. Протон переходит от молекулы воды к иону гидроксида

Так как энергия отрыва протона от молекулы воды больше, чем от иона гидроксония, то вероятность перехода протона от H2O к OH− меньше, чем от Н3O+ к воде. Поэтому 
Предельные подвижности некоторых ионов
|
|
|
Р = 1 атм, t = 25°С
| катион | 
| анион | 
|
| H+(H3O+) | 349,8 | OH- | 198,3 |
| Li+ | 38,6 | F- | 55,4 |
| Na+ | 50,1 | CI- | 76,4 |
| K+ | 73,5 | Br- | 78,1 |
| NH4+ | 73,5 | NO3- | 71,4 |
| Fe3+ | HCOO- | 54,6 |
При одном и том же заряде иона с увеличением радиуса иона увеличивается подвижность иона, так как на поверхности иона уменьшается плотность заряда, уменьшается степень его гидратации и эффективный радиус иона.
|
|
|


