 |
П. 3.3. Определение формального заряда атома в соединении или ионе.
|
|
|
|
Умение приписывать атому в соединении или ионе целочисленный формальный заряд весьма важно, поскольку метильный катион можно обозначить лишь как +СН3 (или СН3+), запись СН3 не может использоваться для обозначения метильного катиона, поскольку СН3 – это электронейтральная частица, образованная из электронейтрального атома углерода и трех электронейтральных атомов водорода, то есть СН3 – это метильный радикал.
ЗАПОМНИТЕ!!!
Неправильное указание формального заряда считается грубой ошибкой. Обычно при этом, в написанном уравнении не выполняется закон сохранения заряда, что тоже является грубейшей ошибкой.
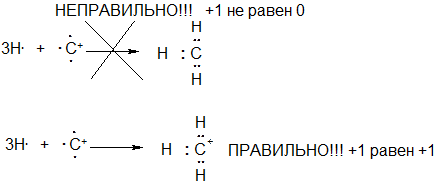
Существует несколько способов определения формального заряда. Так, выше было пояснено, что метильный анион Н3С- получается из трех атомов водорода и аниона С-, и именно поэтому атом углерода в метильном анионе имеет формальный заряд –1, что отражает электронное состояние атома углерода (количество электронов и атомов вокруг него).
Приведем еще один способ определения формального заряда атома. Рассмотрим, к примеру, процесс гетеролитического разрыва свзия С-Н в метане (см. схему) и поясним, что при этом действительно образуется метильный анион и протон.
В процессе разрыва связи получается «атом водорода без электронов», то есть Н+. Уже из этого следует, что вторая из частиц, получающаяся в этом процессе имеет заряд ‑1, поскольку должен выполняться закон сохранения заряда (ВСЕГДА!!!): в левой части стоит электронейтральная молекула метана, следовательно и в правой части реакции суммарный заряд всех частиц должен быть равен нулю (‑1 +1 = 0). То есть и так ясно, что получается отрицательно заряженная частица СН3-. Однако какому конкретно атому (водорода или углерода) следует приписать формальный заряд –1?
|
|
|
Рассмотрим электронное состояние атома углерода (см. схему ниже). Он окружен четырьмя парами электронов: одна из них является неподеленной электронной парой (и принадлежит только углероду), а три другие пары электронов являются связывающими, поскольку они связывают атом углерода с тремя атомами водорода. Два электрона связи С:Н принадлежат как атому углерода, так и атому водорода. Для определения формального заряда углерода поступим следующим образом. Будем считать, что один из электронов связывающей пары электронов С:Н принадлежит углероду, а второй – принадлежит водороду. Углерод в образующейся частице образует три связи С:Н, на которых находится шесть электронов, из этих шести электронов атому углероду принадлежит всего три. На атоме углерода есть еще неподеленная электронная пара, то есть два электрона, полностью принадлежащие углероду. Итого, углероду в полученной частице всего принадлежит 3+2=5 электронов. Напомню, что углерод стоит в четвертой группе, то есть обладает четырьмя валентными электронами. А в полученной частице углерод имеет пять, а не четыре, электрона, то есть один электрон – лишний, а поскольку электрон имеет заряд –1, то атому углерода в полученной частице следует приписать формальный заряд –1.
Аналогичным образом в данном процессе получается «атом водорода без электронов», тогда как у реального атома водорода один валентный электрон. Одного электрона не хватает, то есть получается частица Н+.
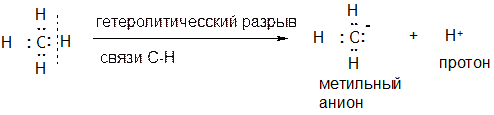
Аналогичным образом рассмотрим процесс гетеролитического разрыва связи С-Н, приведенный ниже. Углерод в полученной частице окружен шестью электронами, но самому углероду из них принадлежит лишь три. Электронейтральный атом углерода имеет четыре электрона, то есть в данном случае одного электрона не хватает и атому углерода в полученной частице следует приписать формальный заряд +1.
|
|
|
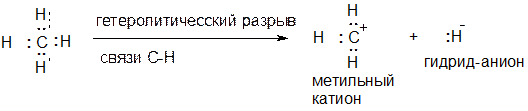
Рассмотрим еще несколько примеров. Вы, вероятно, знаете, что протон Н+ в воде гидратирован и существует в виде иона гидроксония Н3О+. Схема образования молекулы воды из атома кислорода и двух атомов водорода и последующего образования иона гидроксония из молекулы воды и протона изображена ниже.
Напомним, что протон образует ковалентную связь с атомом кислорода молекулы воды по так называемому донорно-акцепторному механизму, когда один атом (донор, он же нуклеофил) предоставляет неподеленную электронную пару, а второй (акцептор, он же электрофил) – пустую орбиталь. В данном случае кислород является донором электронной пары, а протон, обладающий пустой 1s орбиталью является акцептором этой электронной пары.
Понятно, что частица, образующаяся из протона и молекулы воды имеет заряд +1 (ЗАКОН СОХРАНЕНИЯ ЗАРЯДА ВЫПОЛНЯЕТСЯ ВСЕГДА!!!). Однако какому атому приписать формальный заряд +1? Посчитаем количество электронов, принадлежащих атому кислорода в ионе гидроксония. Их количество равно 2 (неподеленная электронная пара на кислороде) плюс 3 (три связи О:Н), то есть пять, а электронейтральный атом имеет шесть валентных электронов, а не пять, поскольку кислород стоит в шестой группе. Одного электрона не хватает. При отрыве одного электрона от атома кислорода он приобретает заряд +1. Итого: в ионе гидроксония заряд +1 формально принадлежит атому кислорода, это его формальный заряд, отражающий его валентное состояние.
Аналогичным образом можно прийти к выводу, что в молекуле воды ни атом кислорода, ни атом водорода не имеют формальных зарядов, поскольку атому кислорода в воде принадлежит 6 электронов, а атому водорода – один, что соответствует нейтральным атомам. Можно также проверить, что в ионе гидроксония Н3О+ атомы водорода не имеют формального заряда, поскольку каждому из атомов водорода принадлежит всего один электрон.
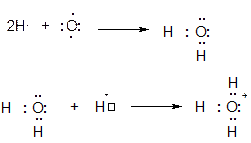
К аналогичным выводам можно прийти и другим путем (см. схему ниже). Атом кислорода стоит в шестой группе и имеет электронную конфигурацию …2s22p4, при этом количество неспаренных электронов равно двум. Именно поэтому атом кислорода двухвалентен и образует к примеру две ковалентные связи О:Н с атомами водорода за счет своих неспаренных электронов (см. предыдущую схему).
|
|
|
Мысленно оторвем от атома кислорода один электрон, что приведет к получению частицы О+, имеющий пять валентных электронов и электронную конфигурацию …2s22p3. В катионе О+ имеется три неспаренных электрона, то есть ион О+ трехвалентен и может образовать три ковалентные связи О:Н по обменному механизму, что приведет к образованию того же самого иона гидроксония Н3О+ с формальным зарядом атома кислорода +1.

ЗАПОМНИТЬ!!!
ТРЕХВАЛЕНТНЫЙ КИСЛОРОД И ЧЕТЫРЕХВАЛЕНТНЫЙ АЗОТ ВСЕГДА ИМЕЮТ ФОРМАЛЬНЫЙ ПОЛОЖИТЕЛЬНЫЙ ЗАРЯД!!! ДВУХВАЛЕНТНЫЙ КИСЛОРОД, ТРЕХВАЛЕНТНЫЙ АЗОТ, ЧЕТЫРЕХВАЛЕНТНЫЙ УГЛЕРОД И ОДНОВАЛЕНТНЫЙ ВОДОРОД, ОДНОВАЛЕНТНЫЕ ФТОР, ХЛОР И БРОМ НЕ ИМЕЮТ ФОРМАЛЬНОГО ЗАРЯДА, ПОСКОЛЬКУ НАХОДЯТСЯ В НАИБОЛЕЕ ХАРАКТЕРНЫХ ДЛЯ НИХ ВАЛЕНТНЫХ СОСТОЯНИЯХ.
Это объясняется тем, что атом кислорода обычно двухвалентен, а азота – трехвалентен, поскольку имеют два и три соответственно неспаренных электрона и используют их для образования ковалентных связей по обменному механизму, то есть по одному неспаренному электрону от каждого из атомов, образующих связь (соединения Н2О, NН3). Дополнительную связь эти атомы могут образовать лишь по донорно-акцепторному механизму, например при взаимодействии воды или аммиака с протоном, поскольку как атом кислорода в воде, так и атом азота в аммиаке имеют неподеленную электронную пару. При образовании ковалентной связи по донорно-акцепторному механизму, атом кислорода или азота отдает не один электрон (как при обменном механизме), а два, то есть отдает один лишний электрон, повышая свой заряд на единицу.
Обратите внимание на следующие примеры и запомните, что трехвалентный кислород и четырехвалентный азот характеризуются формальным зарядом +1.
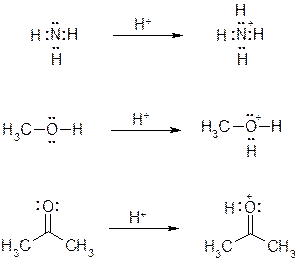
|
|
|


