 |
Особенности механизма взаимодействия алкенов с галогенами.
|
|
|
|
Хлор и бром активно реагируют с алкенами с образованием продуктов присоединения по кратной связи. Реакция алкенов с фтором протекает слишком бурно и приводит к продуктам деструкции углеродного скелета даже при пониженной температуре. Присоединение йода к алкенам в большинстве случаев представляет собой обратимую реакцию, равновесие которой смещено в сторону исходных реагентов.
Рассмотрим механизм взаимодействия пропена с бромом. В качестве электрофильной частицы выступает сама молекула брома. При ее взаимодействии с пропеном одновременно происходит гетеролитический разрыв π‑связи С‑С, гетеролитический разрыв связи Br‑Br и образование связи С‑Br по донорно‑акцепторному механизму (за счет двух электронов, ранее образовывавших π‑связь). По сути дела, молекула брома в этом процессе служит источником электрофильных частиц Br+, которые и присоединяются по двойной углерод‑углеродной связи. Присоединение электрофила при этом происходит так, чтобы образовался более стабильный (в данном случае вторичный) карбокатион VI.

Ранее мы рассматривали процесс присоединения протона Н+ к молекуле пропена, что приводило к изопропильному катиону II. Образование катиона VI исходя из пропена в целом происходит аналогично. В последнее время, однако, появились веские доводы в пользу того, что строение карбокатиона VI существенно отличается от строения изопропильного катиона II. Это отличие связано с тем, что протон Н+ не имеет неподеленных электронных пар, тогда как Br+ обладает тремя парами электронов. За счет одной из неподеленных электронных пар атома брома и пустой орбитали карбокатионного центра (С+) в катионе VI происходит образование по донорно‑акцепторному механизму еще одной связи С‑Br. Получающаяся при этом частица называется ионом бромония, ее строение можно отразить формулой VII:
|
|
|
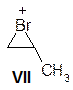
Промежуточным образованием иона бромония принято объяснять тот факт, что при взаимодействии циклогексена с бромом получается транс‑1,2‑дибромциклогексан, то есть процесс присоединения брома по связи С=С алкенов протекает как транс ‑присоединение.
При реакции между бромом и циклогексеном промежуточно образуется ион бромония VIII. На рисунке изображен случай, когда атака молекулы брома осуществлялась сверху относительно плоскости двойной углерод‑углеродной связи, хотя следует понимать, что такая атака равновероятно могла осуществляться и с нижней стороны этой плоскости. В ионе бромония VIII атом брома образует ковалентные связи с обоими атомами углерода бывшей связи С=С, что по пространственным причинам затрудняет последующую атаку бромид-иона сверху. Эта атака вынужденно происходит с обратной строны, в данном случае снизу, и ведет к транс ‑дибромиду.

Сопряжение двойных связей в молекуле 1,3-бутадиена и способы его доказательства. Особенность протекания реакций электрофильного присоединения к бутадиену‑1,3.
Наличие в органическом соединении двух двойных углерод‑углеродных связей обусловливает схожесть его свойств с поведением алкенов. К примеру, химические свойства гексадиена-1,5 в основном аналогичны свойствам этена или пропена, за тем лишь исключением, что этот диен способен взаимодействовать не с одним, а с двумя молями хлороводорода, брома, воды и т.д. При использовании одного моля реагента можно получить продукт моноприсоединения, содержащий только одну связь С=С.

В молекуле гексадиена‑1,5 две двойные связи С=С отделены друг от друга двумя метиленовыми группами СН2. Это соединение относится к так называемым изолированным диенам. Однако, если между связями С=С в диене нет метиленовых групп, т.е. они отделены лишь одинарной связью С‑C, как это имеет место в бутадиене‑1,3, то такие вещества проявляют и некоторые специфические химические свойства. Это связывают с наличием в молекулах таких диенов системы сопряжения двойных углерод‑углеродных связей. Две связи С=С при этом не являются независимыми, они сопряжены и оказывают существенное влияние на свойства друг друга. Бутадиен‑1,3 в связи с этим относится к классу сопряженных диенов.
|
|
|
Рассмотрим строение молекулы бутадиена‑1,3 более подробно. Эту молекулу можно сравнить с двумя объединенными молекулами этена. Каждый из атомов углерода в бутадиене‑1,3 находится в состоянии sp2 гибридизации и образует за счет sp2 гибридных орбиталей три σ‑связи, лежащие в одной плоскости. За счет перекрывания двух пар р‑орбиталей (у атомов углерода С1 и С2, а также у С3 и С4) образуется две π‑связи. Таким образом, в молекуле бутадиена‑1,3 атомы С1 и С2, а также С3 и С4 связаны двойными связями, а атомы С2 и С3 только одинарной.

Описанная модель, полностью применимая к изолированным диенам, все же недостаточно удовлетворительно описывает строение и свойства бутадиена‑1,3. В частности, с ее помощью сложно объяснить некоторые наблюдаемые факты:
1. Длина связи С2‑С3 составляет 0.147 нм, что значительно меньше длины обычной одинарной углерод‑углеродной связи в этане (0.154 нм), но при этом больше длины двойной углерод‑углеродной связи в этене (0.133 нм).
2. Хотя вокруг связи С2‑С3 возможно относительно свободное вращение, большая часть молекул бутадиена‑1,3 находится в состоянии, когда все атомы углерода и водорода располагаются в одной плоскости.
3. При взаимодействии 1 моль бутадиена‑1,3 с 1 моль брома (или с 1 моль галогеноводорода) образуется два структурных изомера, а не один, как в случае гексадиена‑1,5. Интересной особенностью взаимодействия бутадиена‑1,3 с бромом заключается в том, что при пониженной температуре (-40 оС) основным продуктом является 3,4‑дибромбутен‑1 (т.н. продукт 1,2‑присоединения), а при повышенной (+40 оС) – 1,4‑дибромбутен‑2 (т.н. продукт 1,4‑присоединения). Этот факт объясняется тем, что при повышении температуры между двумя изомерными продуктами устанавливается термодинамическое равновесие, поскольку они могут изомеризоваться друг в друга. При этом в смеси преобладает термодинамически более устойчивый продукт (т.н. термодинамический продукт). При пониженной температуре такое равновесие просто не успевает установиться и преобладает тот продукт, который получается быстрее (т.н. кинетический продукт). Примерно такая же картина наблюдается и при присоединении 1 моль галогеноводорода.
|
|
|

Все эти факты могут быть объяснены с привлечением представлений о сопряжении двойных углерод‑углеродных связей в молекуле бутадиена‑1,3. Это явление заключается в частичном перекрывании р‑орбиталей, принадлежащих атомам С2 и С3.

Такое перекрывание наиболее эффективно при копланарности (параллельности) р‑орбиталей, что и обусловливает плоскую форму молекулы. Оно также обеспечивает некоторую двоесвязанность между атомами С2 и С3, что выражается в уменьшении длины связи С2‑С3 по сравнению с одинарной. Последний факт, впрочем, имеет и другое убедительное объяснение, основанное на отличающихся атомных радиусах углеродных атомов, находящихся в различных гибридных состояниях. В качестве довода в пользу сопряжения двух двойных связей в бутадиене часто приводят данные по теплоте гидрирования бутадиена‑1,3 до бутана. Так, теплота гидрирования бутадиена составляет 57.1 ккал/моль. В то же время теплота гидрирования бутена‑1 составляет 30.3 ккал/моль, что позволяет предположить, что для бутадиена‑1,3 эта величина должна составлять 2·30.3 = 60.6 ккал/моль. Разницу между предсказываемой и наблюдаемой величиной в 3.5 ккал/моль часто называют энергией сопряжения в бутадиене‑1,3. Она свидетельствует о некоторой стабилизации молекулы бутадиена за счет сопряжения двойных связей.
|
|
|


