 |
Применение первого начала термодинамики к изопроцессам
|
|
|
|
Среди равновесных процессов, происходящих с термодинамическими системами, выделяются иэопроцессы, при которых один из основных параметров состояния сохраняется постоянным.
Изохорвый процесс (V= const). Диаграмма этого процесса (изохора) в координатах р, V изображается прямой, параллельной оси ординат (рис. 81), где процесс 1— 2 есть изохорнос нагревание, а 1— 3 — изохорное охлаждение. При изохорном процессе газ не совершает работы над внешними телами, т. е.

Как уже указывалось в § S3, из первого начала термодинамики  для
для
изохорного процесса следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии:

Согласно формуле (53.4),

Тогда для произвольной массы газа получим
 (54.1)
(54.1)
Изобарный процесс (р= const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, параллельной оси V. При изобарном процессе работа газа


|

|
(см. (52.2)) при увеличении объема от  до
до 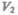 равна
равна
 (542)
(542)
и определяется площадью заштрихованного прямоугольника (рис. 82). Если использовать уравнение (42.5) Клапейрона — Менделеева для выбранных нами двух состояний, то
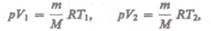
Откуда

Тогда выражение (54.2) для работы изобарного расширения примет вид
 (54.3)
(54.3)
Из этого выражения вытекает физический смысл молярной газовой постоянной R: если  то для 1 моль газа R=A, т. е. R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К.
то для 1 моль газа R=A, т. е. R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К.
В изобарном процессе при сообщении газу массой т количества теплоты

Его внутренняя энергия возрастает на величину (согласно формуле (53.4))

При этом газ совершит работу, определяемую выражением (54.3). Изотермшческий процесс (Т= const). Как уже указывалось § 41, изотермический процесс описывается законом Бойля—Мариотта:
|
|
|
р V= const.


|

|
Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу (см. рис. 60), расположенную на диаграмме тем выше, чем выше температура, при которой происходит процесс.
Исходя из выражений (52.2) и (42.5) найдем работу изотермического расширения газа:

Так как при Т=const внутренняя энергия идеального газа не изменяется:

то из первого начала термодинамики  следует, что для изотермического
следует, что для изотермического
Процесса

т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:
 (54.4)
(54.4)
Следовательно, для того чтобы при расширении газа температура не понижалась, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения.
Адиабатический процесс. Политропный процесс
Адиабатическим называется процесс, при котором отсутствует теплообмен  между системой и окружающей средой. К адиабатическим процессам можно отнести все быстропротекающие процессы. Например, адиабатическим процессом можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько велика, что обмен энергией между волной и средой произойти не
между системой и окружающей средой. К адиабатическим процессам можно отнести все быстропротекающие процессы. Например, адиабатическим процессом можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько велика, что обмен энергией между волной и средой произойти не

Успевает. Адиабатические процессы применяются в двигателях внутреннего сгорания (расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т. д. Из первого начала термодинамики для адиабатического процесса
следует, что 
 (55.1)
(55.1)
Т. е. внешняя работа совершается за счет изменения внутренней энергии системы.
Используя выражения (52.1) и (53.4), для произвольной массы газа перепишем уравнение (55.1) в виде
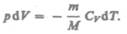 (552) Продифференцировав уравнение состояния для идеального газа
(552) Продифференцировав уравнение состояния для идеального газа  получим
получим
 (55.3) Исключим из (55.2) и (55.3) температуру Т.
(55.3) Исключим из (55.2) и (55.3) температуру Т.
|
|
|

Разделив переменные и учитывая, что  (см. (53.8)), найдем
(см. (53.8)), найдем

Интегрируя это уравнение в пределах от р1 до р2 и соответственно от  а затем
а затем
|
|
|


