 |
Решая полученные уравнения, найдем
|
|
|
|
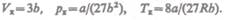 (62.4)
(62.4)
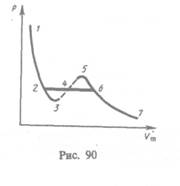
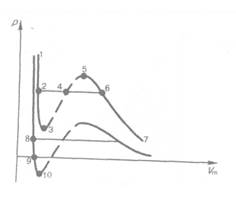
Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колоколообразная кривая (рис. 91), ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят диаграмму  под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар), слева от нее находится область жидкого состояния, а справа — область пара. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращен в жидкость ни при каком давлении.
под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар), слева от нее находится область жидкого состояния, а справа — область пара. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращен в жидкость ни при каком давлении.
Сравнивая изотерму Ван-дер-Ваальса с изотермой Эндрюса (верхняя кривая на рис. 92), видим, что последняя имеет прямолинейный участок 2 — 6, соответствующий двухфазным состояниям вещества. Правда, при некоторых условиях могут быть реализованы состояния, изображаемые участками ван-дер-ваальсовой изотермы 5— б

|
|
 и 2 — 3. Эти неустойчивые состояния называются метастабильными. Участок 2 — 3 изображает перегретую жидкость, 5 — 6 — пересыщенный пар. Обе фазы ограниченно устойчивы.
и 2 — 3. Эти неустойчивые состояния называются метастабильными. Участок 2 — 3 изображает перегретую жидкость, 5 — 6 — пересыщенный пар. Обе фазы ограниченно устойчивы.
При достаточно низких температурах изотерма пересекает ось Vm, переходя в область отрицательных давлений (нижняя кривая на рис. 92). Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются. Участок 8 — 9 на нижней изотерме соответствует перегретой жндкости, участок 9 — 10 — растянутой жидкости.
Внутренняя энергия реального газа
Внутренняя энергия реального газа складывается из кинетической энергии теплового движения его молекул (определяет внутреннюю энергию идеального газа, равную CVT; см. § S3) и потенциальной энергии межмолекулярного взаимодействия. Потенциальная энергия реального газа обусловлена только силами притяжения между молекулами. Наличие сил притяжения приводит к возникновению внутреннего давления на газ (см. (61.1)):
|
|
|
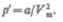
Работа, которая затрачивается для преодоления сил притяжения, действующих между молекулами газа, как известно из механики, идет на увеличение потенциальной энергии
системы, т. е. 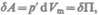 или
или 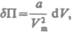 откуда
откуда
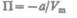
(постоянная интегрирования принята равной нулю). Знак минус означает, что молекулярные силы, создающие внутреннее давление 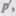 являются силами притяжения (см. § 60). Учитывая оба слагаемых, получим, что внутренняя энергия моля реального газа
являются силами притяжения (см. § 60). Учитывая оба слагаемых, получим, что внутренняя энергия моля реального газа
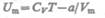 (63.1)
(63.1)
Растет с повышением температуры и увеличением объема.
Если газ расширяется без теплообмена с окружающей средой (адиабатический процесс, т. е.  и не совершает внешней работы (расширение газа в вакуум,
и не совершает внешней работы (расширение газа в вакуум,
т. е.  то на' основании первого начала термодинамики
то на' основании первого начала термодинамики 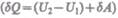


|
|
Получим, что
Ut = U2. (63.2)
Следовательно, при адиабатическом расширении без совершения внешней работы внутренняя энергия газа не изменяется.
Равенство (63.2) формально справедливо как для идеального, так и для реального газов, но физический смысл его для обоих случаев совершенно различен. Для идеального газа равенство U1= U2 означает равенство температур (Т1=Т2,) т. е. при адиабатическом расширении идеального газа в вакуум его температура не изменяется. Для реального газа из равенства (63.2), учитывая, что для моля газа
 (63.3) получаем
(63.3) получаем 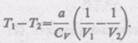
Так как V2>V1 то Т1 > Т2, т. е. реальный газ при адиабатическом расширении в вакуум охлаждается. При адиабатическом сжатии в вакуум реальный газ нагревается.
Эффект Джоуля — Томсона
Если идеальный газ адиабатически расширяется и совершает при этом работу, то он охлаждается, так как работа в данном случае совершается за счет его внутренней энергии (см. § 55). Подобный процесс, но с реальным газом — адиабатическое расширение реального газа с совершением внешними силами положительной работы — осуществили английские физики Дж. Джоуль (1818—1889) и У. Томсоы (лорд Кельвин, 1824—1907).
|
|
|
Рассмотрим эффект Джоуля — Томсона. На рис. 93 представлена схема их опыта. В теплоизолированной трубке с пористой перегородкой находятся два поршня, кото- -рые могут перемешаться без трения. Пусть сначала слева от перегородки газ под поршнем 1 находится под давлением р1 занимает объем К, при температуре Т1,
а справа газ отсутствует (поршень 2 придвинут к перегородке). После прохождения газа через пористую перегородку в правой части газ характеризуется параметрами р2,
V2, Т2. Давления р1ир2 поддерживаются постоянными {р1 >р2).
|
|
|


