 |
В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы.
|
|
|
|
Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа, будет равна сумме кинетических энергий  молекул:
молекул:
 (50.1) Внутренняя энергия для произвольной массы т газа
(50.1) Внутренняя энергия для произвольной массы т газа

где М — молярная масса,  — количество вещества.
— количество вещества.
Первое начало термодинамики
Рассмотрим термодинамическую систему, для которой механическая энергия не изменяется, а изменяется лишь ее внутренняя энергия. Внутренняя энергия системы может изменяться в результате различных процессов, например совершения над системой работы или сообщения ей теплоты. Так, вдвигая поршень в цилиндр, в котором находится газ, мы сжимаем этот газ, в результате чего его температура повышается, т. с. тем самым изменяется (увеличивается) внутренняя энергия газа. С другой стороны, температуру газа и его внутреннюю энергию можно увеличить за счет сообщения ему некоторого количества теплоты — энергии, переданной системе внешними телами путем теплообмена (процесс обмена внутренними энергиями при контакте тел с разными температурами).
Таким образом, можно говорить о двух формах передачи энергии от одних тел к другим: работе и теплоте. Энергия механического движения может превращаться в энергию теплового движения, и наоборот. При этих превращениях соблюдается закон сохранения и превращения энергии; применительно к термодинамическим процессам этим законом и является первое начало термодинамики, установленное в результате обобщения многовековых опытных данных.
Допустим, что некоторая система (газ, заключенный в цилиндр под поршнем), обладая внутренней энергией 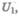 получила некоторое количество теплоты
получила некоторое количество теплоты  и, перейдя в новое состояние, характеризующееся внутренней энергией
и, перейдя в новое состояние, характеризующееся внутренней энергией 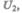 совершила работу А над внешней средой, т. е. против внешних сил. Количество теплоты считается
совершила работу А над внешней средой, т. е. против внешних сил. Количество теплоты считается
|
|
|

|

|
положительным, когда оно подводится к системе, а работа — положительной, когда система совершает ее против внешних сил. Опыт показывает, что в соответствии с законом сохранения энергии при любом способе перехода системы из первого состояния во второе изменение внутренней энергии 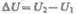 будет одинаковым
будет одинаковым
и равным разности между количеством теплоты  полученным системой, и работой А, совершенной системой против внешних сил:
полученным системой, и работой А, совершенной системой против внешних сил:
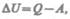
Или
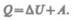 (51.1)
(51.1)
Уравнение (51.1) выражает первое начало термодинамики теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил. Выражение (51.1) в дифференциальной форме будет иметь вид

Или в более корректной форме
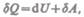 (51.2)
(51.2)
где  — бесконечно малое изменение внутренней энергии системы,
— бесконечно малое изменение внутренней энергии системы, 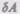 — элементарная работа,
— элементарная работа,  — бесконечно малое количество теплоты. В этом выражении
— бесконечно малое количество теплоты. В этом выражении  является полным дифференциалом, а
является полным дифференциалом, а 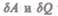 таковыми не являются. В дальнейшем
таковыми не являются. В дальнейшем
Будем использовать запись первого начала термодинамики в форме (51.2).
Из формулы (51.1) следует, что в СИ количество теплоты выражается в тех же единицах, что работа и энергия, т. е. в джоулях (Дж).
Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии 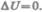 Тогда, согласно первому началу термодинамики,
Тогда, согласно первому началу термодинамики,

Т. е. вечный двигатель первого родя — периодически действующий двигатель, который совершал бы большую работу, чем сообщенная ему извне энергия, — невозможен (одна из формулировок первого начала термодинамики).
§ 52. Работа газа при изменении его объема
Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде (рис. 78). Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу
|
|
|
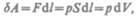
где S — площадь поршня, 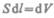 — изменение объема системы. Таким образом,
— изменение объема системы. Таким образом,
 (52.1)
(52.1)
Полную работу А, совершаемую газом при изменении его объема от 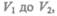 найдем
найдем
интегрированием формулы (52.1):
(52.2)
Результат интегрирования определяется  характером зависимости между давлением и объемом газа. Найденное для работы выражение (52.2) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
характером зависимости между давлением и объемом газа. Найденное для работы выражение (52.2) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах р, V. Пусть изменение давления газа при его расширении изображается гривой на рис. 79. При увеличении объема на dV совершаемая газом работа равна pdV, т. е. определяется площадью полоски с основанием d V, заштрихованной на рисунке. Поэтому полная работа, совершаемая газом при расширении от объема V\ до объема V 2, определяется площадью, ограниченной осью абсцисс, кривой  и прямыми V1 и V2.
и прямыми V1 и V2.
Графически можно изображать только равновесные процесы — процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны (они протекают с конечной скоростью), но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному). В дальнейшем рассматриваемые процессы будем считать равновесными.
Теплоемкость
Удельная теплоемкость вещества — величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
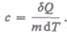
Единица удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг * К)).
Молярная теплоемкость — величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
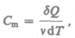 (53.1)
(53.1)
где 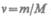 — количество вещества.
— количество вещества.
Единица молярной теплоемкости — джоуль на моль-кельвнн (Дж/(мо ль. К)). Удельная теплоемкость с связана с молярной  соотношением
соотношением
 (532)
(532)
где М — молярная масса вещества.
|
|
|
|
|
|


